- 2021-06-17 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学 第一章 化学反应与能量 1化学反应热的计算
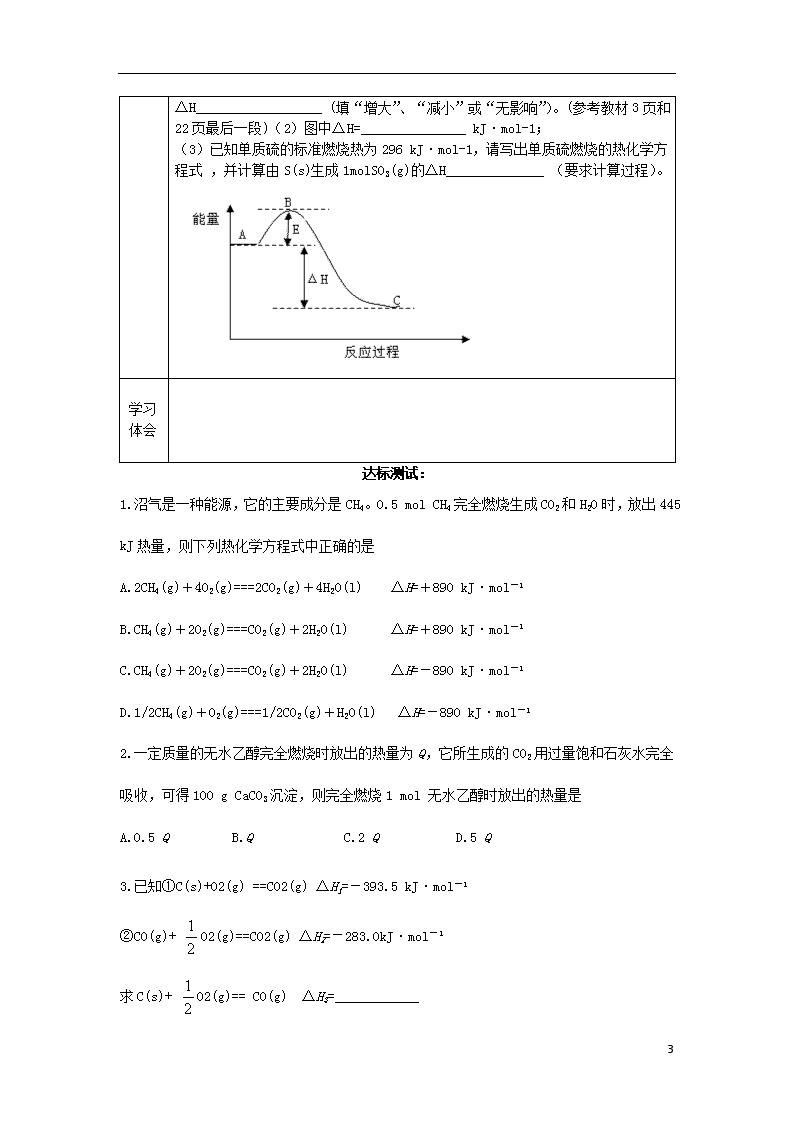
化学反应热的计算 学习目标 1.掌握运用盖斯定律进行计算化学反应的反应热计算 2.提高对热化学方程式内涵的认识,理解热量和物质的量的紧密联系 重点 盖斯定律的应用 利用热化学方程式进行物质反应热量的计算 难点 盖斯定律的应用 学法指导 在熟练掌握反应热、燃烧热、中和热的定义和盖斯定律的含义、热化学方程式的意义和反应物的量与放出的热量成正比的基础上学会计算一个反应的反应热 自学引导︵学生课前必须完成︶ 一、自主学习:(请同学们认真阅读课本12-13页,你一定能完成下列问题) 【旧知识回顾】 1. H2(g)+ O2(g)===H2O(g);ΔH=-241.8 kJ·mol-1 2.燃烧热:________________________________________________________ 根据1的热化学方程式的燃烧热是否为241.8 kJ·mol-1 C—______ H—_____ 二、自主练习:(通过自学,相信自己能解决下列问题)[要求有计算过程] 1. 25℃、101Kpa,将1.0g钠与足量氯气反应,生成氯化钠晶体,并放出18.87kJ热量,求生成1moL氯化钠的反应热? 2. 乙醇的燃烧热: △H=-1366.8kJ/mol,在25℃、101Kpa,1kg乙醇充分燃烧放出多少热量? 3.已知下列反应的反应热: (1)CH3COOH(l)+2O2=2CO2(g)+2H2O(l);△H1=-870.3kJ/mol (2)C(s)+O2(g) =CO2(g);ΔH2=-393.5 kJ/mol (3)H2(g)+O2(g)=H2O(l);△H3=-285.8kJ/mol 试计算下列反应的反应热: 2C(s)+2H2(g)+O2(g) = CH3COOH(l);ΔH=? 3 独立思考 合作探究 例题1.NH3(g)燃烧生成NO2(g)和H2O(g),已知 ①H2(g) + O2(g)==H2O(g) △H=-241.8 kJ/mol ②N2(g)+O2(g)==NO2(g) △H=+33.9 kJ/mol ③N2(g)+ H2(g)==NH3(g) △H=-46 kJ/mol 试计算NH3(g)的燃烧热(过程写在右侧) 例题2. 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的 热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少? 巩固练习 1、(2005全国理综I)已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是 A 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2bkJ/mol B C2H2(g)+5/2O2(g)=2CO2(g)+ H2O(l);ΔH=2bkJ/mol C 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4bkJ/mol D 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=bkJ/mol 2.(08江苏)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1 下列说法正确的是 A CH3OH的燃烧热为192.9kJ·mol-1 B 反应①中的能量变化如右图所示 C CH3OH转变成H2的过程一定要吸收能量 D 根据②推知反应 CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>—192.9kJ·mol-1 3.已知: (1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol (2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol 则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于 A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol 4.(09 全国)2SO2(g)+O2(g)==2SO3(g)反应过程的能量变化如图所示,已知1mol氧化为1mol SO3的ΔH=-99kJ·mol-1。 请回答下列问题:(1)图中A、C分别表示 _______、_______ ,E的大小对该反应的反应热有无影响? ;该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________ ,理由是__________________________________ , 3 △H__________________ (填“增大”、“减小”或“无影响”)。(参考教材3页和22页最后一段)(2)图中△H=_______________ kJ·mol-1; (3)已知单质硫的标准燃烧热为296 kJ·mol-1,请写出单质硫燃烧的热化学方程式 ,并计算由S(s)生成1molSO3(g)的△H______________ (要求计算过程)。 学习体会 达标测试: 1.沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ热量,则下列热化学方程式中正确的是 A.2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1 B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1 C.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 D.1/2CH4(g)+O2(g)===1/2CO2(g)+H2O(l) ΔH=-890 kJ·mol-1 2.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100 g CaCO3沉淀,则完全燃烧1 mol 无水乙醇时放出的热量是 A.0.5 Q B.Q C.2 Q D.5 Q 3.已知①C(s)+O2(g) ==CO2(g) ΔH1=-393.5 kJ·mol-1 ②CO(g)+ O2(g)==CO2(g) ΔH2=-283.0kJ·mol-1 求C(s)+ O2(g)== CO(g) ΔH3=____________ 3查看更多