化学卷·2018届山西省平遥中学高二下学期期中考试(2017
平遥中学2016-2017学年度第二学期高二期中考试
化 学 试 题(理科)
本试卷满分 100分 考试时间100分钟 命题人 王永飞
一、选择题(本题共18个小题,每小题2分,共40分。每小题只有1个答案符合题意。)
1.下列电子层中,包含有f能级的是( )
A.K电子层 B.L电子层 C.M电子层 D.N电子层
2.以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是( )
A. : He B. C.1s2 D.
3.具有以下结构的原子,一定为主族元素原子的是( )
①最外层有3个电子的原子
②最外层电子排布为ns2的原子
③最外层有3个未成对电子的原子
④次外层无未成对电子的原子
A.①④ B.②③ C.①③ D.②④
4.下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第二周期元素
B.位于周期表中第三周期ⅢA族的元素
C.原子最外电子层排布为2s22p6的元素
D.原子最外电子层排布为3s23P5的元素
5.具有下列外围电子排布式的基态原子中,最容易形成离子的是( )
A.3s23p1 B.2s22p2 C.3s2 D.4s24p3
6.若某原子的外围电子排布式为4d15s2,则下列说法正确的是( )
A.该元素在元素周期表中的位置为第五周期第ⅢB族
B.该元素位于s区
C.该元素原子为非金属
D.该元素原子N能层共有8个电子
7. 下列元素性质的递变规律正确的是( )
A.原子半径:Be
N>P>Mg
D.气态氢化物的稳定性:NH3NF3>NCl3 B.NCl3>NF3>NH3
C.NH3>NCl3>NF3 D.NF3>NCl3>NH3
13.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y可能小于X
B.气态氢化物的稳定性:Y强于X
C.最高价含氧酸的酸性:X强于Y
D.X和Y形成化合物时,X显负价,Y显正价
14.下列不能形成配位键的组合是 ( )
A.Ag+、NH3 B.H2O、H+ C.Co3+、CO D.Ag+、H+
15.下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小
B.NH3易液化
C.NH3分子比PH3分子稳定
D.相同条件下,H2O的沸点比H2S的沸点高
16.下列各组分子中都属于含极性键的非极性分子的是( )
A.CO2 H2S B.C2H4 BF3 C.CH3Cl HCN D.NH3 C60
17.下列叙述中正确的是( )
A.能电离出H+的化合物(除水外)都是酸,分子中含有几个氢原子就是几元酸
B.元素的非金属性越强,其含氧酸的酸性就越强
C.含氧酸中,中心原子的化合价越高,其氧化性一定越强
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强
酸而H2CO3是弱酸
18.下列分子含有“手性”碳原子,属于手性分子的是( )
A.CH3CH2OH B.CH3CHO
C.CH3CHClCH2CH2OH D.H2N-CH2-COOH
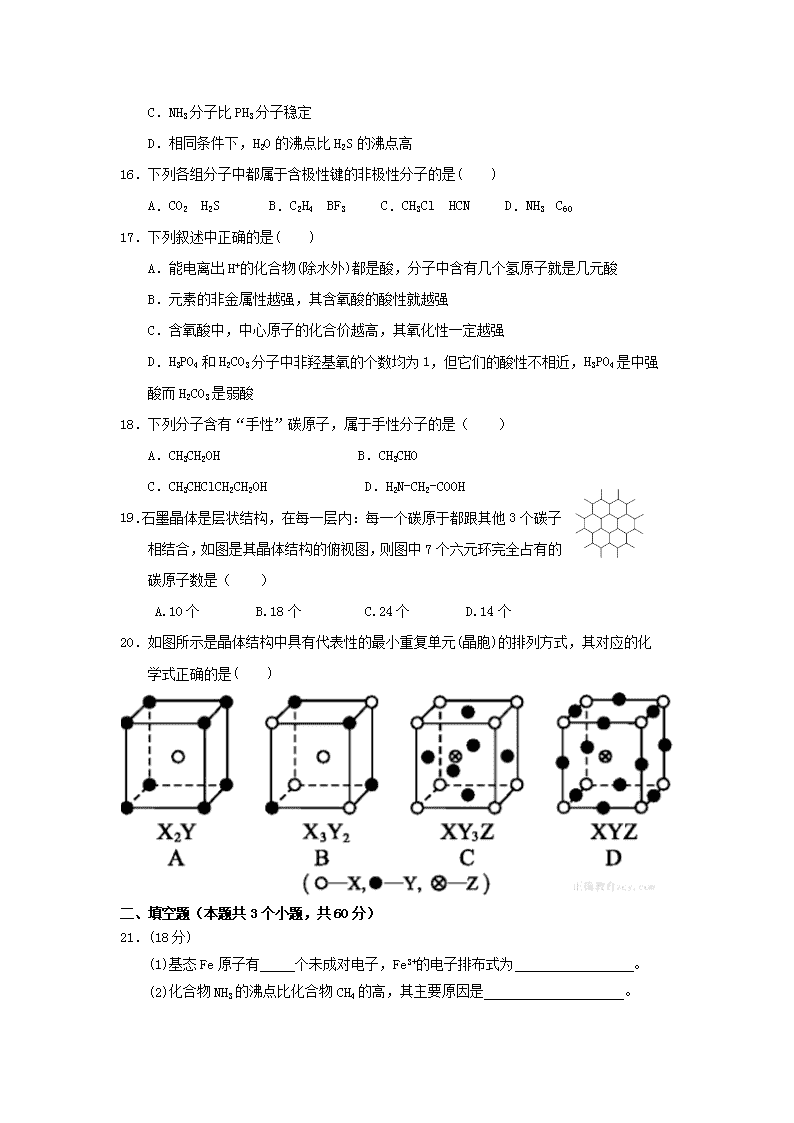
19. 石墨晶体是层状结构,在每一层内:每一个碳原于都跟其他3个碳子
相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的
碳原子数是( )
A.10个 B.18个 C.24个 D.14个
20. 如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化
学式正确的是( )
二、填空题(本题共3个小题,共60分)
21.(18分)
(1)基态Fe原子有 个未成对电子,Fe3+的电子排布式为 。
(2)化合物NH3的沸点比化合物CH4的高,其主要原因是 。
(3)第一电离能介于B、N之间的第二周期元素有 种。
(4)F、K、Fe、Ni四种元素中电负性最大的是 (填元素符号)。
(5)1mol乙醛(CH3CHO)分子中碳原子的杂化轨道类型为 ,含有的σ键的数目
为 。
(6)SO42-的空间构型为 (用文字描述)。写出一种与SO42-互为等电子体
的分子的化学式 。
22. (14分)
氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
(1)写出N2H62+在碱性溶液中反应的离子方程式 。
(2)NH2-的电子式为______________ 。
(3)N3-有 ________个电子。
(4)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式____ 。
(5)等电子数的微粒往往具有相似的结构,试预测N3-的构型___________ 。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物
质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构
尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N
排成V形。如果5个N结合后都达到8电子结构,且含有2个NN叁键。则“N5”
分子碎片所带电荷是_____________ ,写出它的结构式 。
23.(18分)
A、B、C、D为原子序数依次增大的四种元素,A2- 和B+具有相同的电子层结构;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布
式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因
是 ;鉴别A和B形成的离子化合物是否为晶体,最可靠的科
学方法是 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 (用文
字描述,下同),中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,VSEPR模型为 。
平遥中学2016-2017学年度第二学期高二期中考试
化学试题答案(理科)
一、 选择题(本题共20个小题,每小题2分,共40分。每小题只有1个答案符合题意。)
1
2
3
4
5
6
7
8
9
10
D
D
C
D
C
A
C
A
B
C
11
12
13
14
15
16
17
18
19
20
B
C
B
D
C
B
D
C
D
C
二、填空题(本题共3个小题,共60分)
21.(每空2分共18分)
(1)4 1s22s22p63s23p63d5
(2)NH3分子间存在氢键
(3)3
(4)F
(5)sp2 、sp3 ; 6× 6.02×1023或6NA
(6)正四面体 CCl4或SiCl4
22.(每空2分共14分)
(1)N2H62++2OH-==N2H4+2H2O
(2)略
(3)22
(4) N2O;CO2;CNO-;BeF2;CaH2;C3H4 等
(5) 直线型
(6)一个单位正电荷或+1 +
23. (每空2分共18分)
(1)O 1s22s22p63s23p3或3s23p3
(2)O3 O3相对分子质量较大,范德华力大; X射线衍射法
(3)三角锥形 sp3
(4)v形 四面体形