高中化学同步练习 2_3_4 溶解性、手性、无机含氧酸分子的酸性 (人教版选修3)
2.3 分子的性质 第4课时 溶解性、手性、无机含氧酸分子的酸性
练基础落实
知识点1 溶解性
1.利用相似相溶这一经验规律可说明的事实是( )
①HCl易溶于水 ②NH3易溶于H2O ③N2难溶于水 ④HClO4是强酸 ⑤盐酸是强酸 ⑥氢氟酸是弱酸 ⑦HF很稳定
A.①②③ B.④⑤⑥
C.⑥⑦ D.④⑤
2.从碘水中提取碘,可供选择的有机试剂是( )
A.苯、酒精 B.汽油、甘油
C.四氯化碳、汽油 D.二硫化碳、乙醇
3.根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说法正确的是( )
A.溴、碘单质和四氯化碳中都含有卤素
B.溴、碘是单质,四氯化碳是化合物
C.Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D.以上说法都不对
知识点2 手性
4.下列化合物中含3个“手性碳原子”的是( )
5.含手性碳原子的分子称手性分子,手性分子具有光学活性。如下图有机物具有光学活性(式中标有*号的为手性碳原子),也能发生下列反应,请问发生哪种反应后,该有机物仍然一定具有光学活性( )
A.消去反应 B.水解反应
C.银镜反应 D.酯化反应
6.下列物质中不存在手性异构体的是( )
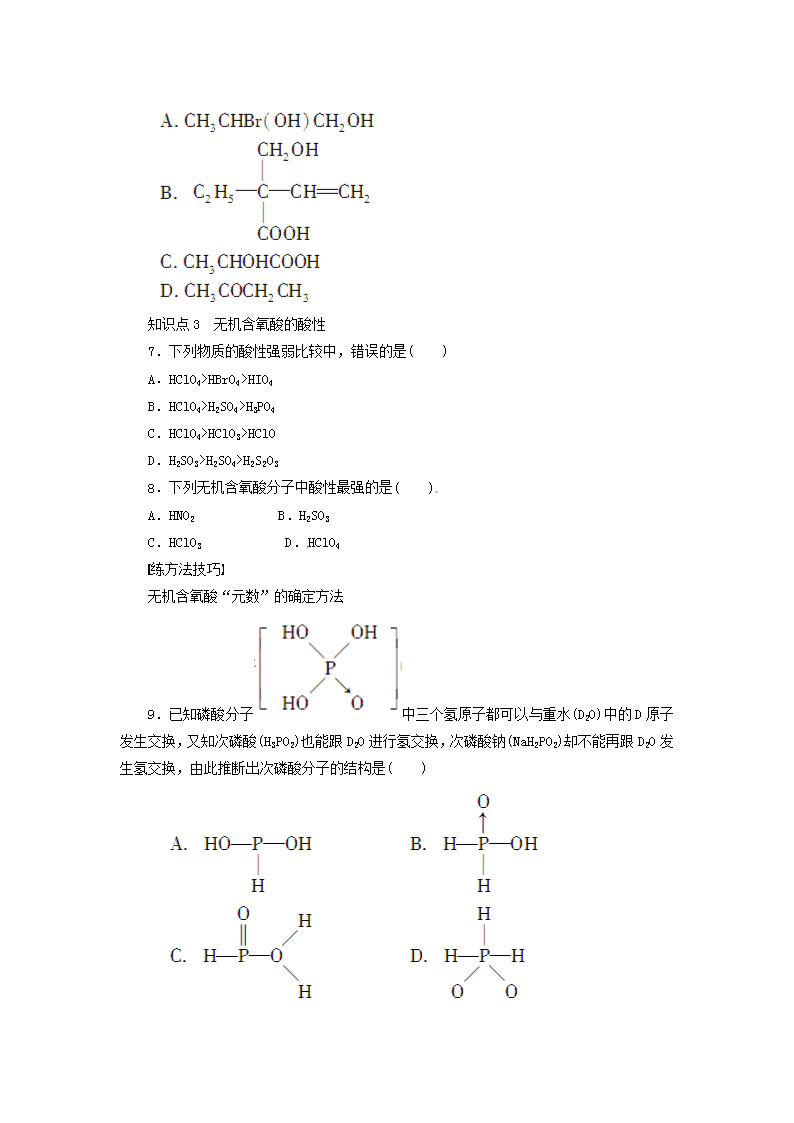
知识点3 无机含氧酸的酸性
7.下列物质的酸性强弱比较中,错误的是( )
A.HClO4>HBrO4>HIO4
B.HClO4>H2SO4>H3PO4
C.HClO4>HClO3>HClO
D.H2SO3>H2SO4>H2S2O3
8.下列无机含氧酸分子中酸性最强的是( )
A.HNO2 B.H2SO3
C.HClO3 D.HClO4
练方法技巧
无机含氧酸“元数”的确定方法
9.已知磷酸分子中三个氢原子都可以与重水(D2O)中的D原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
无机含氧酸的酸性强弱的判断方法
10.下列物质的酸性强弱比较正确的是( )
A.HBrO4
H2SO3
练综合拓展
11.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键;分子间作用力;非极性键
B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
12.PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构____________。
(2)请在以下横线上画出这两种固体分子的几何构型图:淡黄色固体________________,黄绿色固体__________________。
(3)淡黄色固体物质由____________组成,黄绿色固体物质由______________组成(填
“极性分子”或“非极性分子”)。
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是___________________。
参考答案
1.A
2.C [从碘水中提取碘要求该有机试剂(萃取剂)必须易溶解碘,且与水难溶,只有这样才能使碘转移到有机溶剂中与水分离。碘属于非极性分子,易溶于苯、汽油、CCl4、乙醇等有机溶剂,但甘油、酒精由于分子中存在—OH,能与水互溶,所以不能用作萃取剂,故答案为C。]
3.C [根据相似相溶规律:极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂。Cl2、Br2、I2是非极性分子,它们易溶于非极性溶剂——CCl4;而在极性溶剂——水中的溶解度较小。]
4.C
5.C [银镜反应使该物质中的—CHO转化成—COOH,带*号的碳原子所连四个原子或原子团仍不相同。该物质仍然是手性分子,仍具有光学活性。]
6.D
7.D [同一主族元素从上到下,非金属元素最高价含氧酸酸性逐渐减弱,A正确;同一周期元素从左到右,非金属元素最高价含氧酸酸性逐渐增强,B正确;对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强,所以C正确;H2SO4的酸性大于H2SO3,D不正确,虽然我们不熟悉H2S2O3,但不影响判断。]
8.D [HClO4分子中非羟基氧原子数最多,酸性最强。]
9.B [此题是信息题,考查利用信息综合分析、推断的能力。由题给信息首先分析出H3PO4中共价键形式,3个H分别和3个O形成共价单键,与H相连的3个O与P形成3个共价键,从而得出能跟D原子发生交换的条件,由此同理对次磷酸结构作出判断。]
10.D [同一主族从上到下非金属性依次减弱,最高价含氧酸的酸性依次减弱,A项错;同一周期从左到右非金属性依次增强,最高价含氧酸的酸性依次增强,所以B项错;同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,所以C项错,D项正确。]
11.B [因为O的电负性较大,在雪花和水中,H2O分子间存在O—H…O氢键,故在实现雪花→水→水蒸气的变化阶段主要破坏水分子间的氢键,而由水蒸气→氧气和氢气则破坏了O—H极性共价键。]
12.(1)平面正方形
(2)
(3)非极性分子 极性分子
(4)黄绿色固体是由极性分子构成的,而淡黄色固体是由非极性分子构成的,根据“相似相溶”原理可知前者在水中的溶解度大于后者
解析 (1)根据PtCl2(NH3)2可以形成两种固体,即其有两种同分异构体,可知其结构应为平面正方形结构,若为四面体结构则无同分异构体。
(2)PtCl2(NH3)2的两种同分异构体的结构分别为:
① ②。由于淡黄色固体在水中的溶解度较小,因此其分子无极性,其结构为①,则黄绿色固体为极性分子,其结构为②。
(3)根据“相似相溶”原理可知:黄绿色固体是由极性分子构成的,故其在水中的溶解度要大于由非极性分子构成的淡黄色固体。