- 2021-06-17 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮增分策略 加试31题专练
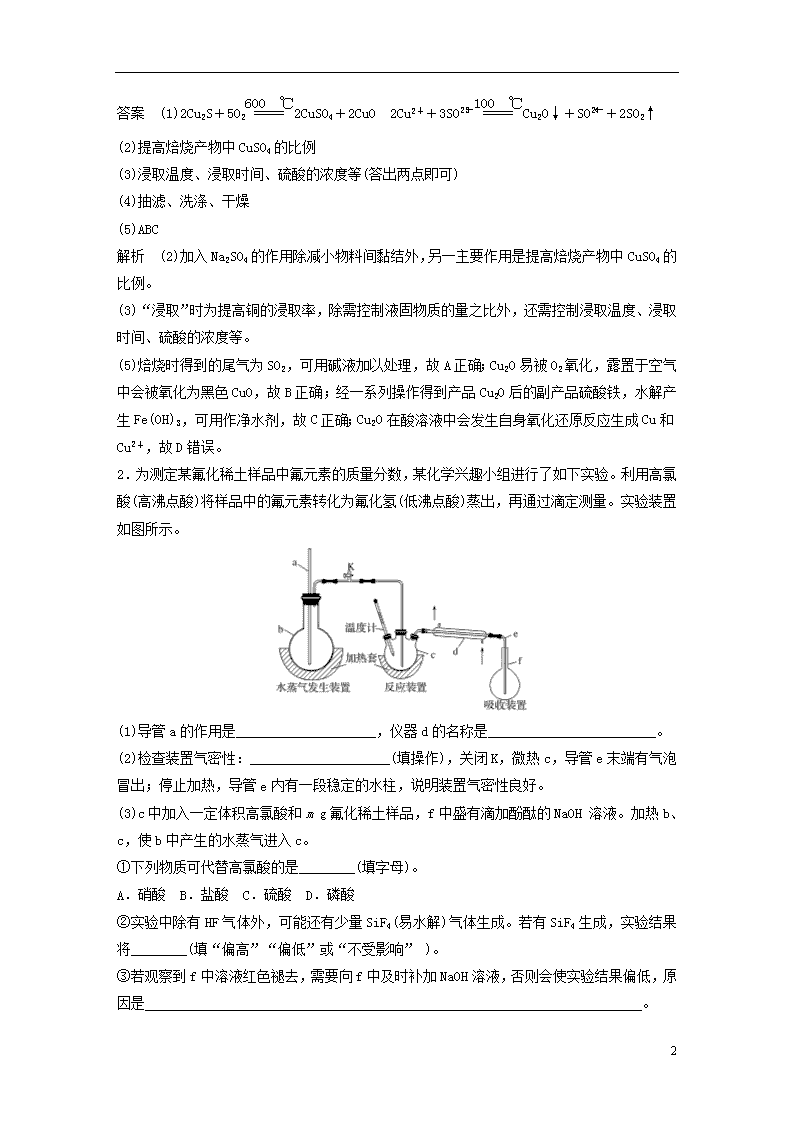
加试31题专练 1.(2018·余姚中学高三选考模拟)Cu2O是一种在涂料、玻璃等领域应用非常广泛的红色氧化物。它不溶于水和醇,溶于盐酸、氯化铵、氨水,易被O2、 硝酸等氧化。一种以硫化铜矿石(含CuFeS2、Cu2S 等)为原料制取Cu2O 的工艺流程如下: (1)“硫酸化焙烧”时,Cu2S与O2反应生成CuSO4等物质的化学方程式为 ________________________________________________________________________; 在100 ℃时,制备过程中发生反应的离子方程式为 ________________________________________________________________________。 (2)加入Na2SO4的作用除减小物料间黏结外,另一主要作用是________________________________________________________________________。 (3)“浸取”时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制_______________________________________________________________ (至少列举两点)。 (4)得到产品Cu2O的一系列操作主要是__________________________________________。 (5)下列有关说法正确的是________。 A.焙烧时得到的尾气可用碱液加以处理 B.Cu2O露置于空气中会变黑 C.经一系列操作得到产品Cu2O后的副产品,经处理后可作净水剂 D.“制备”时,溶液的pH越小,Cu2O 的产率越高 5 答案 (1)2Cu2S+5O22CuSO4+2CuO 2Cu2++3SOCu2O↓+SO+2SO2↑ (2)提高焙烧产物中CuSO4的比例 (3)浸取温度、浸取时间、硫酸的浓度等(答出两点即可) (4)抽滤、洗涤、干燥 (5)ABC 解析 (2)加入Na2SO4的作用除减小物料间黏结外,另一主要作用是提高焙烧产物中CuSO4的比例。 (3)“浸取”时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制浸取温度、浸取时间、硫酸的浓度等。 (5)焙烧时得到的尾气为SO2,可用碱液加以处理,故A正确;Cu2O易被O2氧化,露置于空气中会被氧化为黑色CuO,故B正确;经一系列操作得到产品Cu2O后的副产品硫酸铁,水解产生Fe(OH)3,可用作净水剂,故C正确;Cu2O在酸溶液中会发生自身氧化还原反应生成Cu和Cu2+,故D错误。 2.为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。实验装置如图所示。 (1)导管a的作用是____________________,仪器d的名称是________________________。 (2)检查装置气密性:____________________(填操作),关闭K,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。 (3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH 溶液。加热b、c,使b中产生的水蒸气进入c。 ①下列物质可代替高氯酸的是________(填字母)。 A.硝酸 B.盐酸 C.硫酸 D.磷酸 ②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将________(填“偏高”“偏低”或“不受影响” )。 ③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是_______________________________________________________________________。 5 (4)向馏出液中加入V1 mL c1 mol·L-1 La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余La3+(La3+与EDTA按1∶1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________________。 (5)用样品进行实验前,需要用0.084 g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是__________________。 答案 (1)平衡压强 直形冷凝管 (2) 在b和f中加水,水浸没导管a和e末端 (3)①CD ②不受影响 ③充分吸收HF气体,防止其挥发损失 (4)或% (5)寻找最佳实验条件 解析 (1)a的作用是平衡压强,防止圆底烧瓶中压强过大,引起爆炸,d的名称是直形冷凝管。(3)①利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出;硝酸易挥发,故A项错误;盐酸易挥发,故B项错误;硫酸难挥发,沸点高,故C项正确;磷酸难挥发,沸点高,故D项正确;②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成实验结果将不受影响。(4)氟化稀土样品中氟的质量分数为=。(5)该操作的目的是通过做对比实验,寻找最佳实验条件。 3.(2017·杭州第二中学高三上学期选考)碘酸钙[Ca(IO3)2·6H2O]可以按照如下反应来制备: I2+2KClO3+HCl===KIO3·HIO3+KCl+Cl2↑ KIO3·HIO3+KOH===2KIO3+H2O CaCl2+2KIO3===Ca(IO3)2↓+2KCl 冷却结晶过程中得到的产物随温度不同会带不同数目的结晶水,如下表: 碘酸钙存在形式 Ca(IO3)2 Ca(IO3)2·H2O Ca(IO3)2·6H2O 稳定温度 >57.5 ℃ 32~57.5 ℃ <32 ℃ [实验步骤] Ⅰ.碘酸钙的制备: 如图1接好装置,在圆底烧瓶中依次加入2.54 g 碘、2.50 g 氯酸钾和水,滴加盐酸。通电加热搅拌,水浴温度保持在 85 ℃左右,直至反应完全。将溶液转入烧杯中,滴加KOH溶液至pH≈10,逐渐加入CaCl2溶液,生成白色沉淀,不断搅拌至沉淀完全。反应混合物先用水冷却,再在冰水中静置 10 min,然后用双层滤纸抽滤,用少量冰水洗涤,再用少量无水乙醇洗涤,干燥后得产品3.78 g。 5 Ⅱ.产品纯度分析: 准确称取0.500 0 g 样品,置于烧杯中,加入高氯酸,微热溶解试样,冷却后移入250 mL 容量瓶中,加水稀释定容,摇匀。移取25.00 mL试液置于碘量瓶(如图2)中,加入1∶1高氯酸酸化, 一定量KI 固体,盖上瓶塞,在暗处放置反应3 min,加水,用0.040 00 mol·L-1硫代硫酸钠标准溶液滴至溶液呈浅黄色,加淀粉溶液 2 mL,继续滴定至终点,平行测定多次,实验数据记录如下: 1 2 3 4 滴定起始刻度/mL 0.20 1.52 0.84 1.16 滴定终止刻度/mL 31.53 31.50 30.84 31.18 Na2S2O3 溶液用量/mL 附:本题使用的摩尔质量(g·mol-1) 碘酸钙无水盐:389.88 一水合物:407.90 六水合物:497.99 碘酸钾:214.00 碘:253.80 请回答: (1)本实验中C烧杯内装的溶液是____________,作用是________________。 (2)根据____________现象,可以判定碘与氯酸钾的反应已进行完全。 (3)加入CaCl2溶液后需检验沉淀是否完全,写出检验的步骤及方法________________________________________________________________________。 (4)在进行产品纯度分析的时候,发生了如下反应,请写出第一步的离子方程式: 第一步:________________________________________________________________________; 第二步:2Na2S2O3+I2===Na2S4O6+2NaI。 (5)该实验的产率为__________,产品的纯度为_____________________________________。 (6)下列操作说法中正确的是________。 A.制备过程水浴加热时,冷凝管下口出现固体未作处理会使产率偏低 B.制备过程未使用冰水浴,会使产率偏高 C.产品纯度分析时加入稍过量KI对实验没有影响 5 D.滴定完成后,仰视滴定管读数会使纯度偏高 答案 (1)氢氧化钠溶液 吸收尾气氯气 (2)反应至溶液无色 (3)取上层清液少许于试管中,加入少量CaCl2溶液,若不变浑浊,说明已沉淀完全 (4)IO+5I-+6H+===3I2+3H2O (5)75.91% 99.60% (6)ACD 解析 (5)4次滴定实验,每次消耗Na2S2O3的体积分别为 31.53 mL-0.20 mL=31.33 mL 31.50 mL-1.52 mL=29.98 mL 30.84 mL-0.84 mL=30.00 mL 31.18 mL-1.16 mL=30.02 mL 第1次舍去,平均消耗Na2S2O3的体积为30.00 mL 根据IO+5I-+6H+===3I2+3H2O;2Na2S2O3+I2===Na2S4O6+2NaI得 IO ~ 3I2 ~ 6Na2S2O3 2×10-4 mol 30.00×10-3×0.040 00 =1.2×10-3 mol 所以Ca(IO3)2·6H2O的质量为 ×10 mol×497.99 g·mol-1=0.497 99 g 其纯度为×100%≈99.60% n(I2)=≈0.01 mol n(KClO3)=≈0.02 mol 所以Ca(IO3)2·6H2O的理论产量为 0.01 mol×497.99 g·mol-1=4.979 9 g 产率为×100%≈75.91%。 5查看更多