- 2021-06-08 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届甘肃省会宁县第一中学高二上学期第一次月考(2017
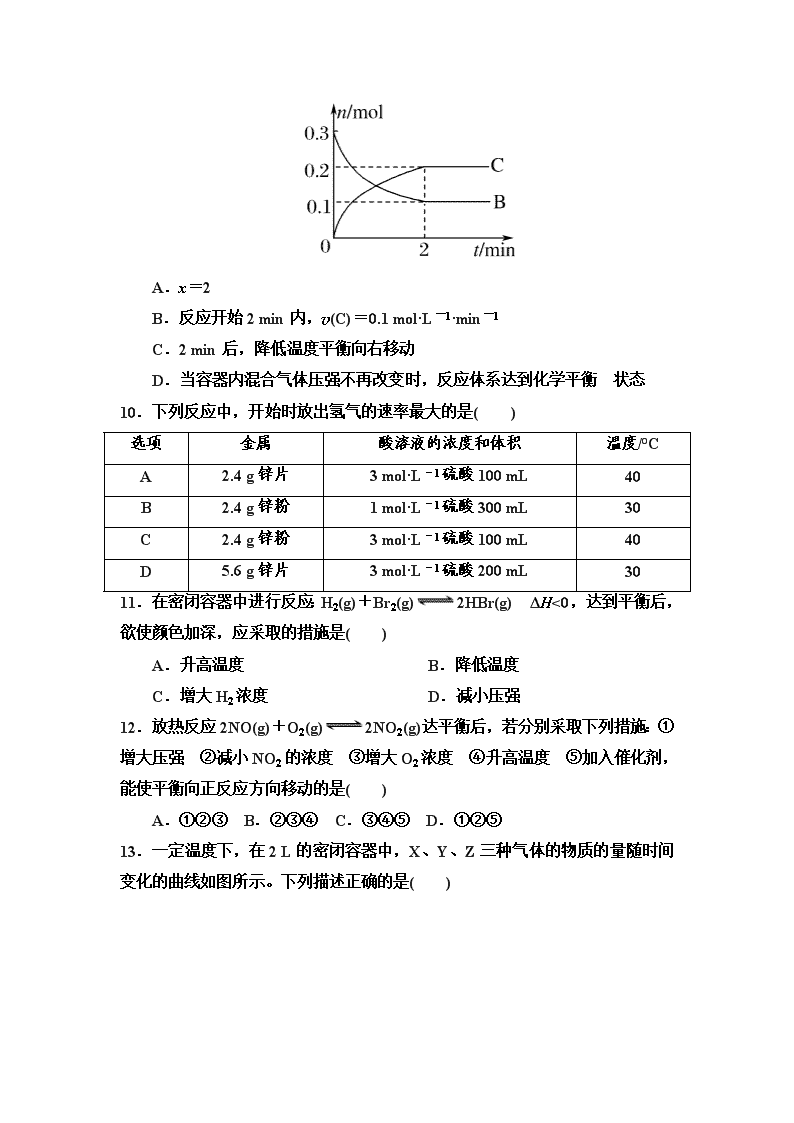
会宁一中2017---2018学年度第一学期高二化学第一次月考 班级: 姓名: 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 一、选择题(本题包括16小题,每小题3分,共48分。每小题只是一个选项符合题意) 1.下列反应中符合图示能量变化的是( ) A.电解Al2O3得到Al和O2 B.HCl分解为H2和Cl2 C.Na与水反应 D.工业上用H2还原Fe2O3制Fe 2.关于能源,以下说法中不正确的是( ) A.煤、石油、天然气等燃料属不可再生能源 B.煤、石油、水煤气可从自然界直接获取,属一级能源 C.太阳能是一级能源、新能源、可再生能源 D.潮汐能来源于月球引力做功 3.已知: ①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1; ②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1。 则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为( ) A.262.6 kJ·mol-1 B.-131.3 kJ·mol-1 C.-352.3 kJ·mol-1 D.131.3 kJ·mol-1 4.在C(固)+CO2(气)===2CO(气)的反应中。现采取下列措施: ①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容 下充入N2 ⑤恒压下充入N2能够使反应速率增大的措施是( ) A. ①④ B.②③⑤ C.①③ D.①②④ 5.下列关于反应能量的说法正确的是 ( )。 A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,则反应物总能量>生成物总能量 B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 C.101 kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1 D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 6.(2013·衡阳联考)反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情 况下的反应速率分别为 ①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1 下列有关反应速率的比较中正确的是( ) A.④>③=②>① B.④<③=②<① C.①>②>③>④ D.④>③>②>① 7.(2013·天津汉沽月考)下列各组物质的燃烧热相等的是( ) A.碳和二氧化碳 B.1 mol碳和3 mol碳 C.3 mol乙炔(C2H2)和1 mol苯 D.淀粉和纤维素 8.2CO(g)+4H2(g)===2CH4(g)+O2(g) ΔH=+71 kJ·mol-1 CO(g)+2H2(g)===CH3OH(l) ΔH=-90.5 kJ·mol-1 已知CH4(g)的燃烧热为-890 kJ·mol-1,则CH3OH(l)的燃烧热为( ) A.-1528 kJ·mol-1 B.-764 kJ·mol-1 C.-382 kJ·mol-1 D.无法计算 9.一定温度下,在2 L的密闭容器中发生反应A(g)+2B(g)xC(g) ΔH<0,B、C的物质的量随时间变化的关系如下图。下列有关说法不正确的是( ) A.x=2 B.反应开始2 min内,v(C)=0.1 mol·L-1·min-1 C.2 min后,降低温度平衡向右移动 D.当容器内混合气体压强不再改变时,反应体系达到化学平衡 状态 10.下列反应中,开始时放出氢气的速率最大的是( ) 选项 金属 酸溶液的浓度和体积 温度/°C A 2.4 g锌片 3 mol·L-1硫酸100 mL 40 B 2.4 g锌粉 1 mol·L-1硫酸300 mL 30 C 2.4 g锌粉 3 mol·L-1硫酸100 mL 40 D 5.6 g锌片 3 mol·L-1硫酸200 mL 30 11.在密闭容器中进行反应:H2(g)+Br2(g)2HBr(g) ΔH<0,达到平衡后,欲使颜色加深,应采取的措施是( ) A.升高温度 B.降低温度 C.增大H2浓度 D.减小压强 12.放热反应2NO(g)+O2(g)2NO2(g)达平衡后,若分别采取下列措施:①增大压强 ②减小NO2的浓度 ③增大O2浓度 ④升高温度 ⑤加入催化剂,能使平衡向正反应方向移动的是( ) A.①②③ B.②③④ C.③④⑤ D.①②⑤ 13.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( ) A.反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1 B.反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1 C.反应进行到10 s时,Y的转化率为79.0% D.反应的化学方程式为X(g)+Y(g)Z(g) 14.一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是 ( )。 A.c1∶c2=1∶3 B.平衡时,Y和Z的生成速率之比为2∶3 C.X、Y的转化率相等 D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1 15.在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g)===2SO3(g) ΔH=-Q kJ/mol, 测得SO2的转化率为90%,则在此条件下反应放出的热量为( ) A.2Q kJ B.Q kJ C.1.8 Q kJ D.0.9Q kJ 16.在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O22SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min末时,容器中SO2的物质的量是( ) A.等于1.6 mol B.等于1.2 mol C.大于1.6 mol D.小于1.2 mol 第二部分 非选择题(52分) 17.(16分)某化学兴趣小组要完成中和热的测定。 (1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是________、________。 (2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? ________(填“能”或“否”),其原因是________________ ________________________________。 (3)他们记录的实验数据如下: 已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·°C-1·kg-1,各物质的密度均为1 g·cm-3。 ①计算完成上表。 ②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:________________。 (4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。 18.(10分)根据下列叙述写出相应的热化学方程式: (1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是 ______________________________________________________________________。 (2)下图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为: _____________________________________________________________________。 (3)拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2完全反应生成NH3的反应热为________,1 mol H2完全反应生成NH3所放出的热量为________。 19.(116分)(1)在一定条件下,可逆反应达到平衡状态的本质特征是________________________,下列关系中能说明反应N2(g)+3H2(g)2NH3(g)已经达到平衡状态的是________。 A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3) C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2) (2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组分的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变。 ①能说明反应N2(g)+3H2(g)2NH3(g)达到平衡状态的有________(填字母); ②能说明反应H2(g)+I2(g)2HI(g)达到平衡状态的有________(填字母); ③能说明反应2NO2(g)N2O4(g)达到平衡状态的有________(填字母); ④能说明反应C(s)+H2O(g)CO(g)+H2(g)达到平衡状态的有________(填字母)。 20.(10分)在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)===2HI(g) ΔH<0。 (1)保持容器容积不变,向其中加入1 mol H2 ,反应速率________,理由是__________________________。 (2)保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率________,理由是_________________________ _____________。 (3)保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率________,理由是________________ ____________________。 (4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率________,理由是____________________ ______________。 (5)提高起始的反应温度,反应速率________,理由是________________________________。 1-16 CBDCA ABBBC AACBC D 17每空2分 (1)量筒 温度计 (2)否 金属易导热,热量散失多,导致误差偏大 (3)①-56.8 kJ·mol-1 ②NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1 (4)无 有 18答案 (1)S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1 3分 (2)2SO2(g)+O2(g)2SO3(g) ΔH=-198 kJ·mol-1 3分 (3)-92 kJ·mol-1 (2分) 30.7 kJ(2分) 19答案:(1)正反应速率与逆反应速率相等 C(每空2分) (2)①a、b、c ②a、b、e ③a、b、c、e ④a、b、c、d(每空3分) 11每空1分 答案:(1)增大 增大反应物氢气的浓度,反应速率增大 (2)不变 反应物的浓度不变,反应速率不变 (3)减小 保持压强不变,向其中充入N2,体积变大,反应物浓度减小,反应速率减小 (4)不变 保持压强不变,向其中充入1 mol H2和1 mol I2,反应物浓度不变,反应速率不变 (5)增大 升高温度,提高活化分子百分数,反应速率增大查看更多