- 2021-06-07 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年四川省广安第二中学高二下学期第二次月考化学试题 Word版
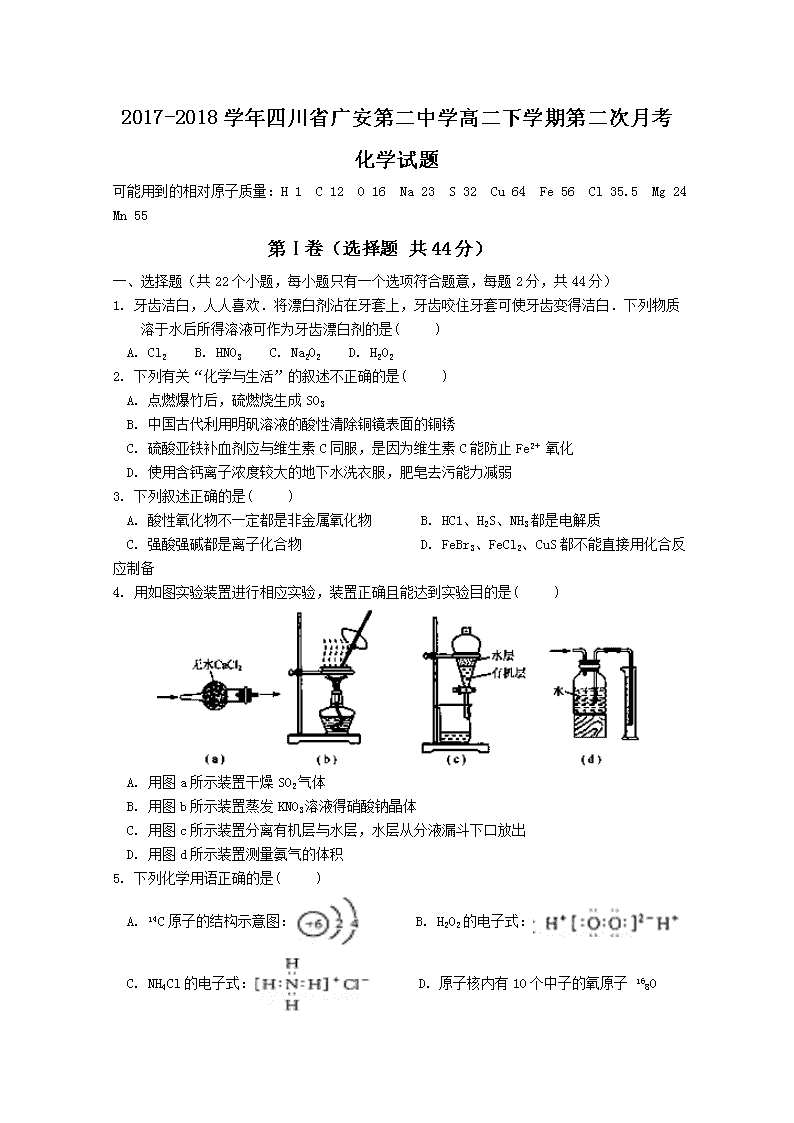
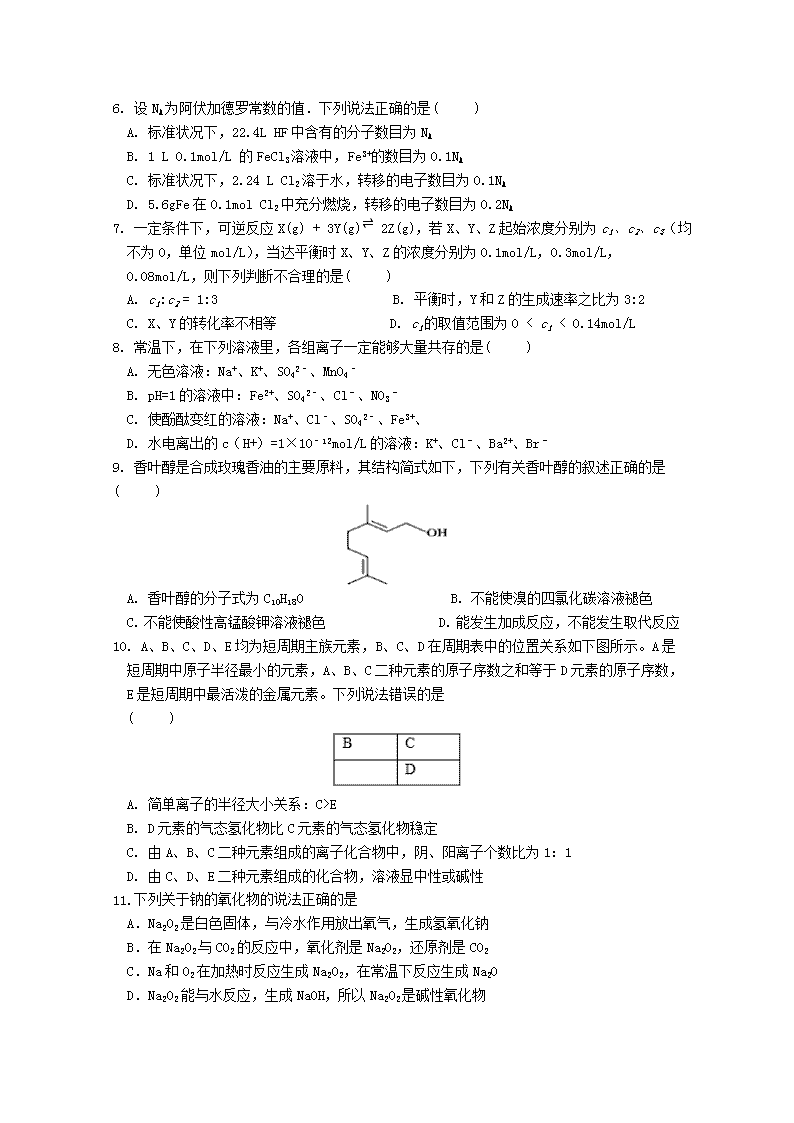
2017-2018学年四川省广安第二中学高二下学期第二次月考 化学试题 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cu 64 Fe 56 Cl 35.5 Mg 24 Mn 55 第Ⅰ卷(选择题 共44分) 一、选择题(共22个小题,每小题只有一个选项符合题意,每题2分,共44分) 1. 牙齿洁白,人人喜欢.将漂白剂沾在牙套上,牙齿咬住牙套可使牙齿变得洁白.下列物质溶于水后所得溶液可作为牙齿漂白剂的是( ) A. Cl2 B. HNO3 C. Na2O2 D. H2O2 2. 下列有关“化学与生活”的叙述不正确的是( ) A. 点燃爆竹后,硫燃烧生成SO3 B. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 C. 硫酸亚铁补血剂应与维生素C同服,是因为维生素C能防止Fe2+ 氧化 D. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 3. 下列叙述正确的是( ) A. 酸性氧化物不一定都是非金属氧化物 B. HC1、H2S、NH3都是电解质 C. 强酸强碱都是离子化合物 D. FeBr3、FeCl2、CuS都不能直接用化合反应制备 4. 用如图实验装置进行相应实验,装置正确且能达到实验目的是( ) A. 用图a所示装置干燥SO2气体 B. 用图b所示装置蒸发KNO3溶液得硝酸钠晶体 C. 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 D. 用图d所示装置测量氨气的体积 5. 下列化学用语正确的是( ) A. 14C原子的结构示意图: B. H2O2的电子式: C. NH4Cl的电子式: D. 原子核内有10个中子的氧原子 168O 6. 设NA为阿伏加德罗常数的值.下列说法正确的是( ) A. 标准状况下,22.4L HF中含有的分子数目为NA B. 1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA C. 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA D. 5.6gFe在0.1mol Cl2中充分燃烧,转移的电子数目为0.2NA 7. 一定条件下,可逆反应X(g) + 3Y(g)⇌ 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( ) A. c1:c2 = 1:3 B. 平衡时,Y和Z的生成速率之比为3:2 C. X、Y的转化率不相等 D. c1的取值范围为0 < c1 < 0.14mol/L 8. 常温下,在下列溶液里,各组离子一定能够大量共存的是( ) A. 无色溶液:Na+、K+、SO42﹣、MnO4﹣ B. pH=1的溶液中:Fe2+、SO42﹣、Cl﹣、NO3﹣ C. 使酚酞变红的溶液:Na+、Cl﹣、SO42﹣、Fe3+、 D. 水电离出的c(H+)=1×10﹣12mol/L的溶液:K+、Cl﹣、Ba2+、Br﹣ 9. 香叶醇是合成玫瑰香油的主要原料,其结构简式如下,下列有关香叶醇的叙述正确的是 ( ) A. 香叶醇的分子式为C10H18O B. 不能使溴的四氯化碳溶液褪色 C. 不能使酸性高锰酸钾溶液褪色 D. 能发生加成反应,不能发生取代反应 10. A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C二种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是 ( ) A. 简单离子的半径大小关系:C>E B. D元素的气态氢化物比C元素的气态氢化物稳定 C. 由A、B、C二种元素组成的离子化合物中,阴、阳离子个数比为1:1 D. 由C、D、E二种元素组成的化合物,溶液显中性或碱性 11.下列关于钠的氧化物的说法正确的是 A.Na2O2是白色固体,与冷水作用放出氧气,生成氢氧化钠 B.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2 C.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O D.Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物 12. 有机物数量庞大,下列有关它们的说法中正确的是 ( ) A. 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别 B. 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 C. 合成纤维、人造纤维及碳纤维都属于有机高分子材料 D. 苯能发生加成反应、取代反应但不能发生氧化反应 13. 分子是为C5H12O且可与金属钠反应放出氢气的有机物有(不考虑立体异构) ( ) A. 5种 B. 6种 C. 7种 D. 8种 14. 下列陈述Ⅰ和Ⅱ均正确,并存在因果关系的是( ) 陈述Ⅰ 陈述Ⅱ A BaSO4难溶于水 SO2气体通入Ba(NO3)2溶液中产生白色沉淀 B 非金属性:Cl>S 酸性:HClO3>H2SO4 C 常温下,NaHCO3的溶解度比Na2CO3小 向饱和Na2CO3溶液中通入CO2产生沉淀 D 常温下,SO2与氢硫酸和NaOH溶液均可反应 SO2是两性氧化物 A. A B. B C. C D. D 15. 下列离子方程式书写正确的是 ( ) A. 向NaHSO4溶液中滴Ba(OH)2溶液,恰好使SO42-沉淀完全:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ B. 向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- C. 加热可增强纯碱溶液去污力:CO32-+2H2O⇌H2CO3+2OH- D. 过量CO2通入Ca(ClO)2溶液中: ClO-+CO2+H2O=HCO3-+HClO 16. 下列物质中既有极性键,又有非极性键的非极性分子是( ) A. 二氧化碳 B. 四氯化碳 C. 双氧水 D. 乙炔 17. 下列说法或有关化学用语的表达正确的是( ) A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 B. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 C. 基态Fe原子的外围电子排布图为 D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 18.已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是 A. 若A是铁,则E可能为稀硝酸 B. 若A是CuO,E是碳,则B为CO C. 若A是NaOH溶液,E是CO2,则B为NaHCO3 D. 若A是AlCl3溶液,E可能是氨水 19.在恒容恒温的密闭容器中充入1molX和2molY,发生反应: X(g)+2Y(g)2Z(g)+M(s) △H=-akJ/mol(a>0),下列说法正确的是 A.当v正(X) = v逆(M),说明反应达到平衡状态 B.达到化学平衡状态时,反应放出的总热量为akJ C.反应达到平衡时,X和Y的转化率相等 D.降低反应温度,正反应速率增大,逆反应速率减小 20.如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是 A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 B.甲池通入CH3OH的电极反应为CH3OH﹣6e﹣+2H2O=CO32﹣+8H+ C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 21. 25℃时,将浓度均为0.1 mol/L、体积分别为Va 和Vb 的HA溶液与BOH溶液按不同体积比混合,保持Va + Vb = 100 mL, Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是 A. Ka(HA)=Kb(BOH)=10-5 B. b点时, c(B+)=c(A-)≠c(H+)=c(OH-) C. c点时, 随温度升高不变 D. a→c过程中水的电离程度先增大后减小. 22.检验某溶液中是否含有K+、 Fe3+、 Cl-、 Mg2+、 I-、 CO32-、 SO42-,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是 A.试剂①为硝酸钡 B.试剂②一定为盐酸 C.该溶液中一定有I-、 CO32-、 SO42-、 K+ D.通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl- 第II卷(非选择题共56分) 二、必做题(该题包含4个小题,共44分) 23(10分)). X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表: X Y Z M R Q 原子半径/nm 0.099 0.186 0.074 0.143 主要化合价 +4,-4 -2 -1,+7 +3 其他 常温下为黄色固体 无机非金属材料的主角 颜色反应为黄色 其氧化物可做耐火材料 (1)Q在元素周期表中的位置是______. (2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号) a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性:HR>YH4 c.Y与R形成的化的中Y呈正价 (3)根据表中数据推测,Y的原子半径的最小范围是______. (4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______. (5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。 24(11分). Na2S2O3∙5H2O在化学定量分析中常用作基准物质,实验室制备原理为 2Na2S + Na2CO3 + 4SO2 3Na2S2O3 + CO2。现设计如下装置(夹持仪器省略)进行实验。 ⑴ A中发生反应的化学方程式为_______________________________。 ⑵ C中所盛试剂可能是_______________;若要停止A中的化学反应,除取下酒精灯加热外,还可以采取的操作是__________________________。 ⑶ 甲同学在加热A后,发现液面下的铜丝变黑。该同学对黑色生成物提出如下假设: ① 可能是CuO; ② 可能是Cu2O; ③ 可能是CuS 乙同学认为假设②一定不成立,依据是__________;该同学设计如下实验进一步验证黑色物质的组成: 基于上述假设分析,黑色物质的组成为________(填化学式)。 ⑷ 实验室用Na2S2O3标准溶液测定废水中Ba2+ 的浓度,过程如下: (已知:2S2O32-+I2==S4O62-+2I-)。 ① 写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式:________; ② 若以淀粉为指示剂,则达到滴定终点时的现象是__________________。 ③ 若Na2S2O3标准溶液的浓度为0.0030 mol∙L-1,消耗该Na2S2O3标准溶液的体积如图所示,则废水中Ba2+ 的浓度为___________。 25 (11分). 发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。 (1)将煤转化成水煤气的反应:C(s)+H2O(g)⇌CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H______(填“增大”、“减小”或“不变”),判断的理由是________。 (2)CO2制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。 ① 该反应化学平衡常数K的表达式是____________________。 ②0----9min时间内,该反应的平均反应速率ν(H2) =_______。 ③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。 a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98 ④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图所示,L和X分别表示温度或压强。 i. X表示的物理量是:__________ ii. 判断L1与L2的大小关系,并简述理由:___________。 26.(12分)MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示: NaClO3 (1)第①步反应中的硫酸能否用浓盐酸代替? (填“能”或“否”),理由是 。 (2)第②步操作中,氧化性强弱顺序:ClO3— MnO2(填“>”或“<”),写出操作②中发反应的离子方程式: ;当反应中转移2mol电子时,生成的氧化产物的物质的量为 mol。 (3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。制取K2MnO4的化学反应方程式为 ,工业上不断搅拌的目的是 。 (4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量: MnO2+4HCl+2KIMnCl2+I2+2KCl+2H2O I2+2Na2S2O32NaI+Na2S4O6 取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为 %(杂质不参与反应)。 三、选做题(共12分,本题共有两个小题,只选做一题,请将你选做的题下方框用2B铅笔图黑) 27.(12分)选做题-----选修3 物质结构与性质 (1) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、(PAN)、HCOOH、等二次污染物。 ① 1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。 ② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。 ③ 相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是__________________。 (2) PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。 ① (NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。 a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键 ② NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。 (3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图(甲)所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。 图(甲) 图(乙) (4) 最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图(乙)所示。已知晶胞参数a=333.7 pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。 28.(12分)选做题----选修5 有机化学基础 利用所学知识,按以下步骤从 合成 .(部分试剂和反应条件已略去) 请回答下列问题: (1)E中含有的官能团名称为____________;D的结构简式为________________ (2)④的反应类型为___________________。 (3)写出反应⑦的化学方程式______________________________________。 (4)的同分异构体中,能与NaHCO3溶液反应产生气泡的有__________种。 (5)写出反应③的化学方程式______________________________ 答案 一、选择题(共22个小题,每小题只有一个选项符合题意,每题2分,共44分) 1. D 2. A 3.A。4.B。5.A6. D 7.C 8. D9. A 10. B 11.C12.B。13.D。14. C15.D。16. D 17.C18.D19. C20 D21C22D 二、非选择题(该题包含5个小题,共56分) 23.(10分)) (1). 第三周期第ⅢA族 (2). Cl bc (3). 0.099~0.143nm (4). Na2SiO3 (5). SO2(g)+O2(g)⇌SO3(g) ; ∆H=-99 kJ/mol 24. (11分) (1). Cu+2H2SO4CuSO4+SO2↑+2H2O (2). NaOH溶液 将铜丝抽离液面 (3). Cu2O是砖红色沉淀 CuS (4). 淀粉溶液由蓝色变为无色,且半分钟内不变色 0.0011mol/L或1.1×10-3 mol/L 25. (11分) (1). 不变 加入催化剂反应物和生成物的总能量不变 (2). K= 0.25mol∙L-1∙min-1 c 温度 (7). L1>L2,温度一定时,增大压强,CO2平衡转化率增大 26.(12 分)(1)否;浓盐酸能被MnO2氧化生成Cl2; (2)>;5Mn2++2 ClO3—+4H2O5MnO2+Cl2↑+8H+;1; (3) 2MnO2+4KOH+O22 K2 MnO4+2H2O (2分);使反应物与O2充分接触; ( 4)0.435V/a 27、(12分) (1). 10 N>C>O 6 1s22s22p63s23p63d6 或【Ar】3d6 高 HCOOH分子间能形成氢键 (2). de 正四面体 sp2 (3)3 (4).1.61 (2分) 28.(12分)(1)碳碳双键、溴原子;(2)消去反应 (3) (4)8 (5) 查看更多