- 2021-06-07 发布 |
- 37.5 KB |
- 36页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习原电池化学电源课件(36张)
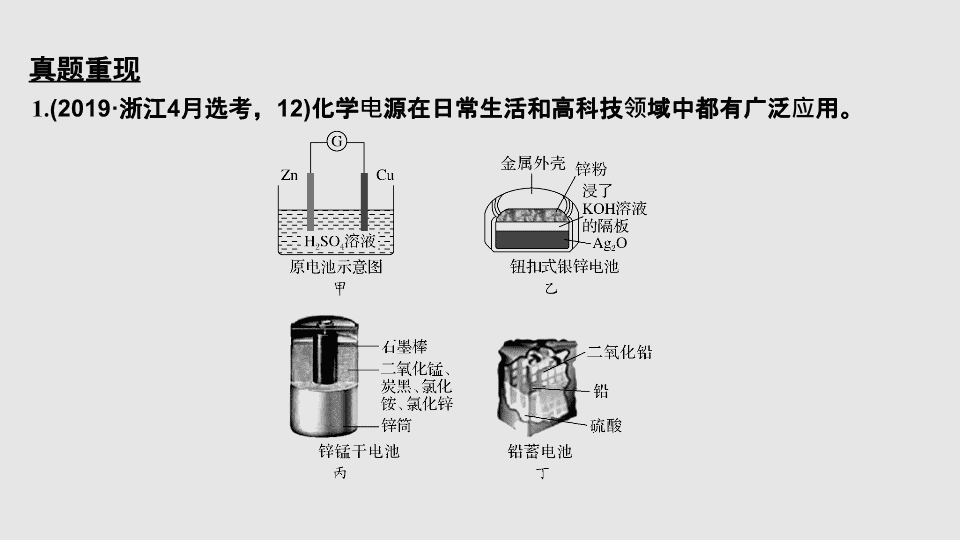
专题九 电化学 第 1 课时 原电池 化学电源 命题调研 (2016 ~ 2019 四年大数据 ) 2016 ~ 2019 四年考向分布 核心素养与考情预测 核心素养: 模型认知、变化推理、科学创新 考情解码: 本部分主要以一个陌生的化学电源为背景,主要考查电池正负极判断,电极方程式的书写,电子或离子流向等几个方面考点。电极方程式的书写和盐桥、离子交换膜的作用是本题的难点,但整体题目难度适中。预测 2020 选考仍将保留往年的考查形式,不会有大的变动。 真题重现 1. (2019· 浙江 4 月选考, 12) 化学电源在日常生活和高科技领域中都有广泛应用。 下列说法不正确的是 ( ) A. 甲: Zn 2 + 向 Cu 电极方向移动, Cu 电极附近溶液中 H + 浓度增加 B. 乙:正极的电极反应式为 Ag 2 O + 2e - + H 2 O===2Ag + 2OH - C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄 D. 丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 解析 铜锌原电池 ( 电解质溶液为硫酸 ) 中铜作正极,电极反应为 2H + + 2e - ===H 2 ↑ ,故铜电极附近 H + 浓度降低, A 项错误。 答案 A 2. (2019· 浙江 1 月学考 ) 氢氧燃料电池构造如图所示。其电池反应方程式为: 2H 2 + O 2 ===2H 2 O ,下列说法不正确的是 ( ) A. 多孔金属 a 作负极 B. 多孔金属 b 上, O 2 发生还原反应 C. 电池工作时,电解质溶液中 OH - 移向 a 极 D. 正极的电极反应为: O 2 + 4e - + 4H + ===2H 2 O 解析 由电池反应方程式可知,还原剂氢气在负极多孔金属 a 上放电,电极反应式为 H 2 - 2e - + 2OH - ===2H 2 O ,氧化剂氧气在正极多孔金属 b 上放电,电极反应式为 O 2 + 4e - + 2H 2 O===4OH - 。 A 项、还原剂氢气在负极多孔金属 a 上放电,故 A 正确; B 项、氧化剂氧气在正极多孔金属 b 上放电,发生还原反应,故 B 正确; C 项、电池工作时,阴离子向负极移动,电解质溶液中 OH - 移向 a 极,故 C 正确; D 项、氧化剂氧气在正极多孔金属 b 上放电,电极反应式为 O 2 + 4e - + 2H 2 O===4OH - ,故 D 错误。故选 D 。 答案 D 3. (2018· 浙江 11 月选考 ) 最近,科学家研发了 “ 全氢电池 ” ,其工作原理如图所示。下列说法不正确的是 ( ) 答案 C 4. [2018· 浙江 6 月学考 ] 普通锌锰干电池的构造如图所示, 答案 C 5. [2018· 浙江 4 月选考 ] 锂 (Li)— 空气电池的工作原理如图所示,下列说法不正确的是 ( ) A. 金属锂作负极,发生氧化反应 B.Li + 通过有机电解质向水溶液处移动 C. 正极的电极反应: O 2 + 4e - ===2O 2 - D. 电池总反应: 4Li + O 2 + 2H 2 O===4LiOH 解析 锂 (Li) 空气电池,锂作负极,通空气一端作为正极。负极反应 Li - e - ===Li + ,正极 O 2 + 4e - + 2H 2 O===4OH - ,总反应 4Li + O 2 + 2H 2 O===4LiOH 。原电池中阳离子向正极移动,阴离子向负极移动。所以 A 、 B 、 D 正确。 C 错误,正极反应: O 2 + 4e - + 2H 2 O===4OH - 。 答案 C 6. (2017· 浙江 11 月选考 ) 金属 (M) -空气电池的工作原理如图所示。下列说法不正确的是 ( ) A. 金属 M 作电池负极 B. 电解质是熔融的 MO C. 正极的电极反应 O 2 + 4e - + 2H 2 O===4OH - D. 电池反应 2M + O 2 + 2H 2 O===2M(OH) 2 解析 金属 (M) -空气电池中 M 失电子作负极,故 A 正确;根据传递 M 2 + 和 OH - ,可知电解质是熔融的 M(OH) 2 ,故 B 错误;空气得电子通空气的一端做正极,电极反应 O 2 + 4e - + 2H 2 O===4OH - ,故 C 正确;电池总反应为 2M + O 2 + 2H 2 O===2M(OH) 2 ,故 D 正确。 答案 B 考向一 原电池正、负极判断 1. 某电池以 K 2 FeO 4 和 Zn 为电极材料, KOH 溶液为电解质溶液。下列说法正确的是 ( ) 答案 A 判断电池的正、负极是解决原电池题目的基础,在此基础上我们可以解决诸如被氧化或被还原问题,电子、电流流向问题,溶液中离子流向问题。我们一般可以通过以下方法来判断原电池的正、负极: (1) 根据组成原电池的两极材料判断 一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。 (2) 根据电流方向或电子流动方向判断 在外电路,电流由正极流向负极;电子由负极流向正极。 (3) 根据原电池里电解质溶液中离子的定向移动方向判断 在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。 备考策略 (4) 根据原电池两极发生的变化判断 原电池的负极发生氧化反应,正极发生还原反应。 (5) 根据 X 极质量变化判断 工作后, X 极质量增加,说明 X 极有物质析出, X 极为正极;反之, X 极质量减少,说明 X 极金属溶解, X 极为负极。 (6) 根据 X 极有无气体产生判断 工作后, X 极上有气体产生,一般是发生了析出 H 2 的电极反应,说明 X 极为正极。 (7) 根据 X 极附近 pH 的变化判断 析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的 pH 增大,因而工作后, X 极附近 pH 增大了,说明 X 为正极。 考向二 原电池工作原理 2. (2019· 浙江名师预测卷 ) nature 期刊报道一例 CH 3 OH—O 2 在新型聚合物催化下的原电池反应,其装置如图。下列说法不正确的是 ( ) 答案 B 在以往的选考题中,命题者经常在电流或电子流向,溶液中离子的移动,被氧化或被还原,正负极的反应现象等方面进行考查,我们只有深刻理解了原电池的工作原理的基础上才能轻松作答,具体可以参考以下总结。 备考策略 考向三 电极、电池反应式的书写 3.MgAgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 ( ) A. 负极反应式为 Mg - 2e - ===Mg 2 + B. 正极反应式为 Ag + + e - ===Ag C. 电池放电时 Cl - 由正极向负极迁移 D. 负极会发生副反应 Mg + 2H 2 O===Mg(OH) 2 + H 2 ↑ 解析 根据题意, Mg 海水 AgCl 电池总反应式为 Mg + 2AgCl===MgCl 2 + 2Ag 。 A 项,负极反应式为 Mg - 2e - ===Mg 2 + ,正确; B 项,正极反应式为 2AgCl + 2e - ===2Cl - + 2Ag ,错误; C 项,对原电池来说,阴离子由正极移向负极,正确; D 项,由于镁是活泼金属,则负极会发生副反应 Mg + 2H 2 O===Mg(OH) 2 + H 2 ↑ ,正确。 答案 B 4. (2018· 河南省焦作市测试题 ) 通过 CO 传感器可监测 CO 的含量,总反应为 2K 2 FeO 4 + 3CO + 2KOH + 2H 2 O===2Fe(OH) 3 + 3K 2 CO 3 ,其工作原理示意图如右,下列说法正确的是 ( ) 答案 D 电极方程式的书写是原电池题目的难点所在,要写出符合实际和题意的电极方程式需要考虑以下几个方面: 1. 正负极材料; 2. 电解质溶液中的离子,尤其是酸碱性; 3. 电极方程式; 4. 氧化还原中的化合价知识;具体可以参照以下方法和步骤: 备考策略 在书写电极方程式时一定要注意以下问题: 1. 正负电极反应式中的电子得失数目保持相等。例如 AlCuCuSO 4 构成的原电池的正极反应可表示为: 3Cu 2 + + 6e - ===3Cu ,负极反应式为: 2Al - 6e - ===2Al 3 + 。 2. 看负极反应生成的阳离子与电解质溶液中的阴离子能否共存,若不能共存,则该电解质溶液中的阴离子也要写入负极的电极反应式中。如 ZnAgKOH 溶液构成的原电池中,因 Zn 失去电子生成的 Zn 2 + 能与 OH - 反应,故负极上发生的反应为: Zn - 2e - + 2OH - ===Zn(OH) 2 。 3. 要注意电解质溶液的性质。当正极上的反应物质为 O 2 时,若溶液为碱性或中性时,电极反应式中不能出现 H + ,电极反应式只能为 O 2 + 2H 2 O + 4e - ===4OH - ;若溶液为酸性时,电极反应式中不能出现 OH - ,电极反应式为: O 2 + 4H + + 4e - ===2H 2 O 考向四 交换膜的作用 5. 一种锂铜可充电电池,工作原理如下图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片 (Li + 交换膜 ) 隔开。下列说法不正确的是 ( ) A. 陶瓷片允许 Li + 通过,不允许水分子通过 B. 放电时, N 极为电池的正极 C. 充电时,阳极反应为: Cu - 2e - ===Cu 2 + D. 充电时,接线柱 A 应与外接电源的正极相连 解析 A . 非水系电解液和水系电解液被锂离子固体电解质陶瓷片 (Li + 交换膜 ) 隔开,则陶瓷片允许 Li + 通过,不允许水分子通过,故 A 正确; B. 放电时,金属锂是负极,发生失电子的氧化反应, M 是负极, N 为电池的正极,故 B 正确; C. 充电时,阳极反应和放电时的正极反应互为逆过程,电极反应为: Cu - 2e - ===Cu 2 + ,故 C 正确; D. 充电时,接线柱 A 应与 M 极相连, M 是负极,所以 A 外接电源的负极,故 D 错误;故选 D 。 答案 D 备考策略 在原电池的考查中,经常涉及到各种交换膜,对于交换膜我们要注意以下知识点: 1. 离子交换膜的功能: 使离子选择性定向迁移 ( 目的是平衡整个溶液的离子浓度或电荷 ) 。 2. 离子交换膜在电化学中的作用: (1) 隔离某些物质防止发生反应。 (2) 用于物质的制备。 (3) 物质分离、提纯等。 3. 离子交换膜的类型: 根据透过的微粒,离子交换膜可以分为多种,在高考试题中主要出现阳离子交换膜、阴离子交换膜和质子交换膜三种。阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,阴离子交换膜只允许阴离子通过,质子交换膜只允许质子 (H + ) 通过。可见离子交换膜的功能在于选择性地通过某些离子和阻止某些离子来隔离某些物质。 考向五 空气电池 6. (2018· 暨阳联合考试 ) 用原电池原理可以处理硫酸工业产生的 SO 2 尾气。现将 SO 2 通入如图装置 ( 电极均为惰性材料 ) 进行实验。下列说法不正确的是 ( ) 答案 B 7. (2018· 浙江温州高三适应性测试 ) 某电化学气敏传感器的工作原理如图所示,下列说法不正确的是 ( ) A.a 极为负极 B.b 极的电极反应式为 O 2 + 4e - + 2H 2 O===4OH - C. 电解质溶液中的 OH - 移向 a 极 D. 该传感器工作一段时间后,电解质溶液的 pH 值将变大 解析 该传感器在工作过程中,负极上氨气失电子生成氮气,则 a 为负极,氧气在正极上得电子生成氢氧根离子,其电池的总反应为 4NH 3 + 3O 2 ===2N 2 + 6H 2 O 。 A. 该传感器在工作过程中,负极上氨气失电子生成氮气,则 a 为负极,故 A 正确; B. 氧气在正极上得电子生成氢氧根离子, b 极的电极反应式为 O 2 + 4e - + 2H 2 O===4OH - ,故 B 正确; C. 碱性条件下,氨气失电子生成氮气和水,则 a 极的电极反应式为 2NH 3 + 6OH - - 6e - ===N 2 + 6H 2 O ,消耗 OH - ,电解质溶液中的 OH - 移向 a 极,故 C 正确; D. 该传感器在工作过程中总反应为 4NH 3 + 3O 2 ===2N 2 + 6H 2 O ,所以 KOH 的物质的量不变,但生成 H 2 O 浓度减小, pH 值减小,故 D 错误;故选 D 。 答案 D 空气电池也是常见的考查方式,其本质是我们常见的燃料电池的工作原理,我们可以参考燃料电池的解题方法来解题:参与负极反应的物质不一定就是负极材料,也可能是充入负极的燃料,参与正极反应的物质不是正极材料本身,而是充入到正极的空气。其中写电极方程式也可以借鉴燃料电池的书写方法,一般先写正极的电极方程式。我们需要熟记以下四种情况: (1) 酸性电解质溶液环境下电极反应式: O 2 + 4H + + 4e - ===2H 2 O 。 备考策略查看更多