- 2021-06-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届四川省凉山木里中学高二上学期期中考试(2017
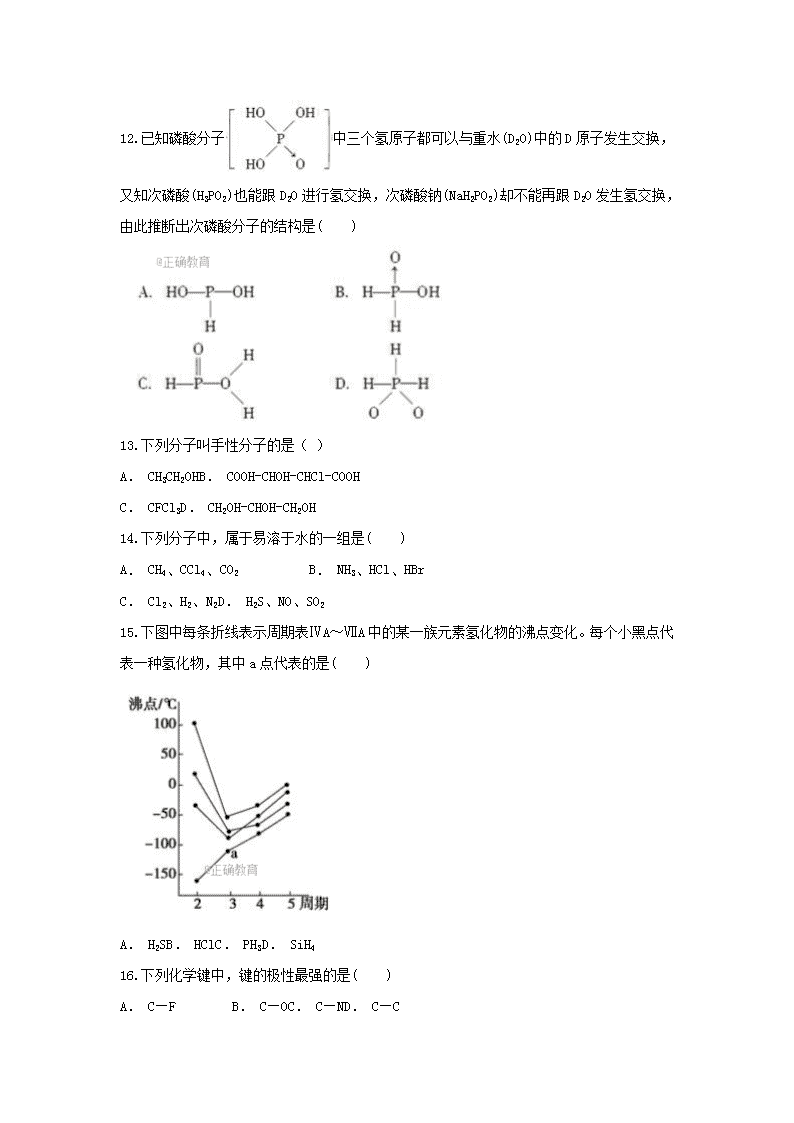
2017-2018学年上期木里中学高二化学半期试卷 姓名:___________教学班级:___________ 教师姓名:考号:__________ 一、选择题(共24小题,每小题2分,共48分) 1.现有四种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5 则下列有关比较中正确的是( ) A. 第一电离能:④>③>②>①B. 原子半径:④>③>②>① C. 电负性:④>③>②>①D. 最高正化合价:④>③=②>① 2.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( ) A. Y元素最高价氧化物对应水化物的化学式为H2YO4 B. X与W可以形成W2X、W2X2两种化合物 C. X的气态氢化物的稳定性比Z的气态氢化物的稳定性弱 D. Y、Z两元素的气态氢化物中,Z的气态氢化物较稳定 3.下列有关微粒性质的排列顺序中错误的是( ) A. 原子半径:Na>S>OB. 稳定性:PH3<H2S<H2O C. 离子半径:Al3+>Mg2+>Na+D. 第一电离能:O<F<Ne 4.不能作为判断元素的非金属性强弱依据的是( ) A. 元素的最高价氧化物对应水化物的酸性强弱 B. 元素的单质跟氢气反应生成气态氢化物的难易程度 C. 非金属元素对应的气态氢化物的稳定性 D. 非金属元素单质的熔点和沸点的高低 5.同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判断正确的是( ) ①阴离子的还原性按X、Y、Z顺序减弱 ②单质的氧化性按X、Y、Z顺序增强 ③元素的原子半径按X、Y、Z顺序减小 ④气态氢化物的稳定性按X、Y、Z顺序减弱 A. ①②B. ②③C. ①②③D. ①②③④ 6.下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1) 下列关于元素R的判断中一定正确的是( ) A. R的最高正价为+3价 B. R元素位于元素周期表中第ⅡA族 C. R元素的原子最外层共有4个电子 D. R元素基态原子的电子排布式为1s22s2 7.如图表示前20号元素的原子序数和气态原子失去核外第一个电子所需的能量的变化关系,其中A、B、C各点表示的元素是( ) A. N、S、PB. F、Cl、OC. He、Ne、ArD. Si、C、B 8.下列各组粒子半径大小的比较中错误的是( ) A. K>Na>LiB. Na+>Mg2+>Al3+ C. Mg2+>Na+>F-D. Cl->F->F 9.下列氧原子的电子排布图中,正确的是( ) A.B. C.D. 10.若不断地升高温度,实现“雪花―→水―→水蒸气―→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( ) A. 氢键;分子间作用力;非极性键 B. 氢键;氢键;极性键 C. 氢键;极性键;分子间作用力 D. 分子间作用力;氢键;非极性键 11.下列氯元素含氧酸酸性最强的是( ) A. HClO B. HClO2C. HClO3D. HClO4 12.已知磷酸分子中三个氢原子都可以与重水(D2O)中的D原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( ) 13.下列分子叫手性分子的是( ) A. CH3CH2OHB. COOH-CHOH-CHCl-COOH C. CFCl3D. CH2OH-CHOH-CH2OH 14.下列分子中,属于易溶于水的一组是( ) A. CH4、CCl4、CO2 B. NH3、HCl、HBr C. Cl2、H2、N2D. H2S、NO、SO2 15.下图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是( ) A. H2SB. HClC. PH3D. SiH4 16.下列化学键中,键的极性最强的是( ) A. C—F B. C—OC. C—ND. C—C 17.下列对[Zn(NH3)4]SO4配合物的说法不正确的是( ) A. SO42﹣是内界B. 配位数是4 C. Zn2+是中心离子D. NH3是配位体 18.用价层电子对互斥理论预测H2S和NH3的立体结构,两个结论都正确的是( ) A. 直线形;三角锥形B. V形;三角锥形 C. 直线形;平面三角形D. V形;平面三角形 19.下列固体分类中正确的一组是( ) 20.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( ) A. Mg2CNi3B. MgC2NiC. MgCNi2D. MgCNi3 21.下面的排序不正确的是( ) A. 晶体熔点由低到高:F2查看更多