- 2021-06-07 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年安徽省蚌埠铁路中学高二上学期期中检测化学试题(Word版)
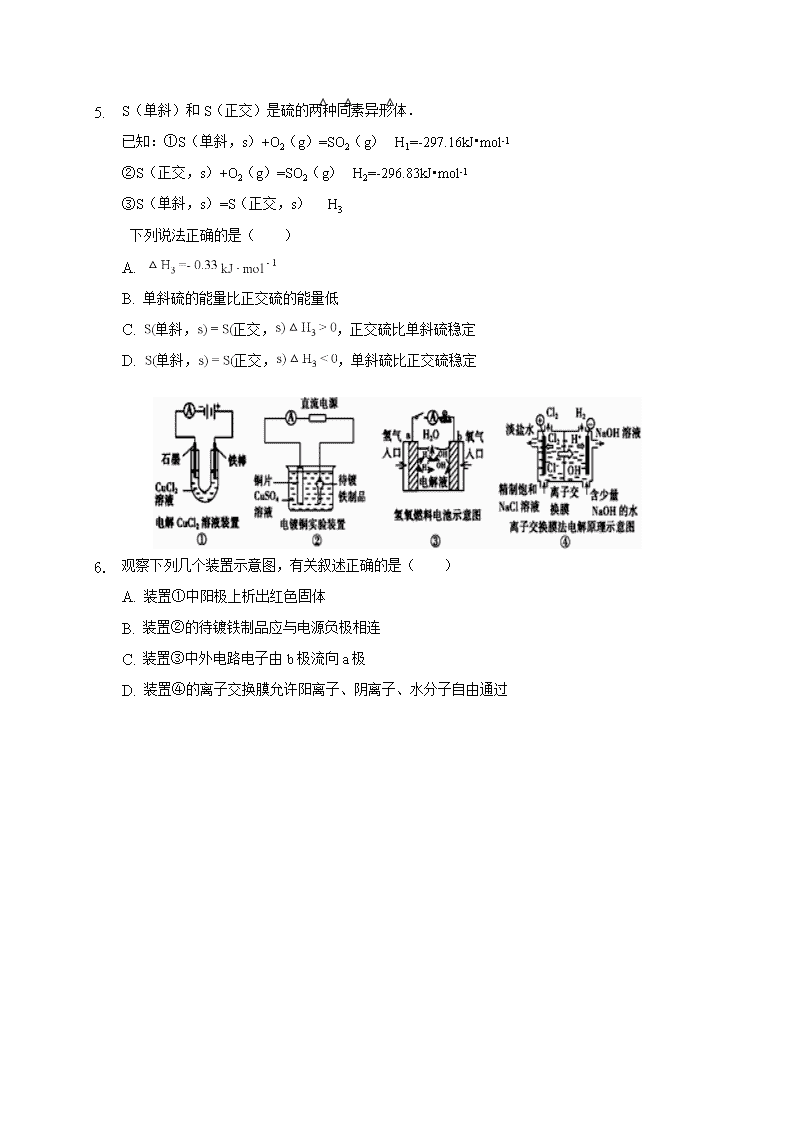
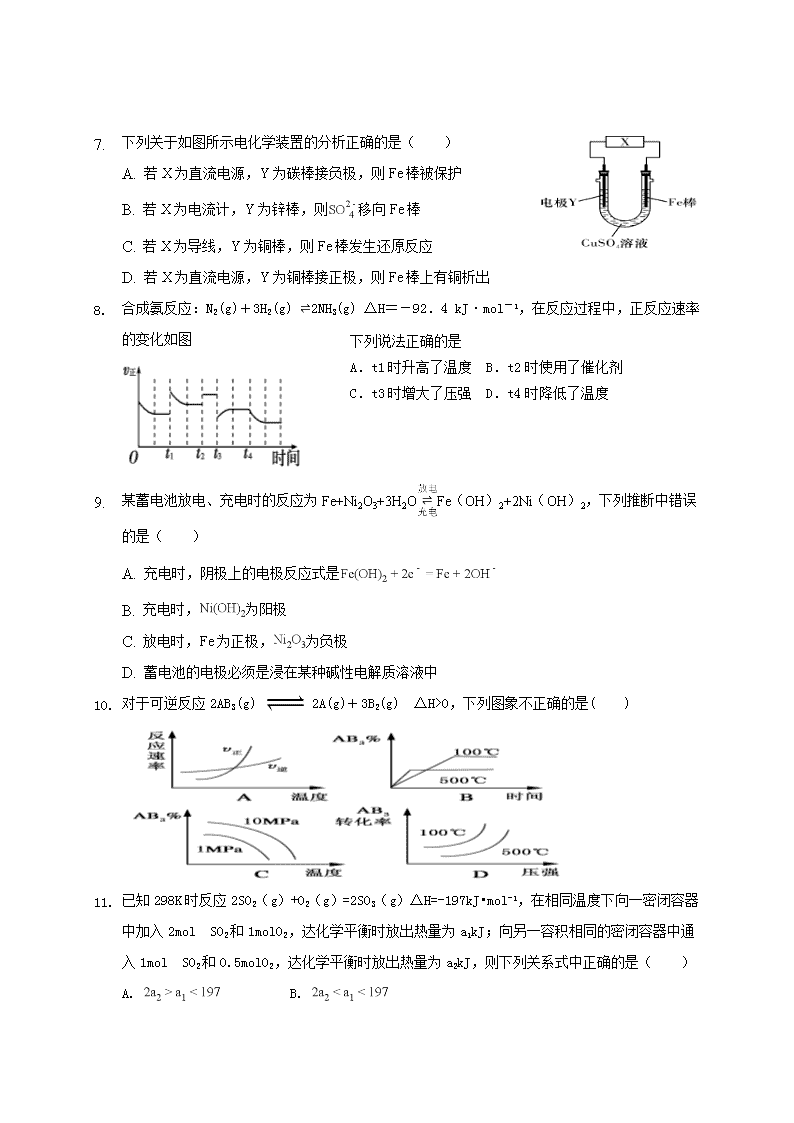
蚌埠铁中2018-2019学年度第一学期期中检测试卷 高 二 化 学 考试时间:90分钟 试卷分值:100分 一、单选题(本大题共18小题,共54分) 1. 反应A(g)+3B(g)⇌2C(g)+2D(g)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( ) A. B. C. D. 2. 下列关于化学反应速率的说法中,不正确的是( ) A. 反应速率用于衡量化学反应进行的快慢 B. 决定反应速率的主要因素是反应物的性质 C. 升高温度,正反应速率增大,逆反应速率减小 D. 增大反应物的浓度、提高反应温度都能增大反应速率 3. 在催化剂作用下,H2O2发生分解,其能量变化如图所示,下列说法正确的是( ) A. 分解反应的 B. 催化剂的加入使反应的热效应减小 C. 催化剂的加入增大了反应平衡常数 D. 催化剂通过改变反应历程、降低反应的活化能来提高分解速率 4. 已知反应①101kPa时,2C(s)+O2(g)═2CO(g)△H=﹣221kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l)△H=﹣57.3kJ/mol下列结论正确的是( ) A.碳的燃烧热大于110.5 kJ/mol B.①反应的焓变为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为﹣57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 1. S(单斜)和S(正交)是硫的两种同素异形体. 已知:①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1 ②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1 ③S(单斜,s)=S(正交,s) △H3 下列说法正确的是( ) A. B. 单斜硫的能量比正交硫的能量低 C. 单斜,正交,,正交硫比单斜硫稳定 D. 单斜,正交,,单斜硫比正交硫稳定 2. 观察下列几个装置示意图,有关叙述正确的是( ) A. 装置①中阳极上析出红色固体 B. 装置②的待镀铁制品应与电源负极相连 C. 装置③中外电路电子由b极流向a极 D. 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 1. 下列关于如图所示电化学装置的分析正确的是( ) A. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 B. 若X为电流计,Y为锌棒,则移向Fe棒 C. 若X为导线,Y为铜棒,则Fe棒发生还原反应 D. 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 下列说法正确的是 A.t1时升高了温度 B.t2时使用了催化剂 C.t3时增大了压强 D.t4时降低了温度 2. 合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图 3. 某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2,下列推断中错误的是( ) A. 充电时,阴极上的电极反应式是 B. 充电时,为阳极 C. 放电时,Fe为正极,为负极 D. 蓄电池的电极必须是浸在某种碱性电解质溶液中 4. 对于可逆反应2AB3(g) 2A(g)+3B2(g) ΔH>0,下列图象不正确的是( ) 5. 已知298K时反应2SO2(g)+O2(g)=2SO3(g)△H=-197kJ•mol-1,在相同温度下向一密闭容器中加入2mol SO2和1molO2,达化学平衡时放出热量为a1kJ;向另一容积相同的密闭容器中通入1mol SO2和0.5molO2,达化学平衡时放出热量为a2kJ,则下列关系式中正确的是( ) A. B. C. D. 1. 工业上利用可逆反应N2(g)+3H2(g)⇌2NH3(g)合成氨,下列叙述正确的是( ) A. 合成氨的适宜条件是高温、高压、催化剂,其中催化剂提高了反应物的转化率B. 恒容通入氩气,使反应体系的压强增大,反应速率一定增大 C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间 D. 在、时刻,的浓度分别是、(c1≠c2),则时间间隔内,生成的平均速率为 2. 已知反应:CO(g)⇌C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度而变化,下列说法中正确的是( ) A. 低温下是自发变化 B. 高温下是自发变化 C. 低温下是非自发变化,高温下是自发变化 D. 任何温度下都是非自发变化 3. 下列变化不能用勒夏特列原理解释的是( ) A. 氯水宜保存在低温、避光条件下 B. 、、HI混合气体加压后颜色变深 C. 催化氧化成的反应,往往加入过量的空气 D. 打开汽水瓶,看到有大量的气泡逸出 4. 在一密闭容器中,反应a A(g) b B(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则( ) A.平衡向正反应方向移动了 B.物质B的质量分数减小了 C.物质A的转化率减少了 D.a>b 16、用惰性电极电解CuSO4溶液,一段时间后取出电极。向电解后的溶液中加入9.8g的Cu(OH)2,充分反应后所得溶液与电解前相同,则电解时电路中通过电子的物质的量是( )A.0.4mol B.0.3mol C.0.2mol D.0.1mol 17、100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)⇌2NO2 (g).下列结论不能说明上述反应在该条件下已经达到平衡状态的是( ) ①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等 ③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化 ⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深 ⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化. A. B. C. 只有 D. 只有 18、用石墨作电极,电解下列物质的水溶液,溶液的pH保持不变的是( ) A、HCl B、NaOH C、Na2SO4 D、NaCl 蚌埠铁中2018-2019学年度第一学期期中检测答题卷 高 二 化 学 考试时间:90分钟 试卷分值:100分 一、 单选题(本大题共18小题,共54分) 题号 1 2 3 4 5 6 7 8 9 答案 题号 10 11 12 13 14 15 16 17 18 答案 二、 填空题(共40分) 1、现在氨(NH3)、肼(N2H4)等含氮化合物在生产、生活中具有重要用途。 (1) 肼通常用作火箭燃料,在一定条件下可与N204反应生成氮气和水,肼用作火箭燃料的优点有:单位质量的燃料燃烧释放的热值高、 ,在反应中肼作 (填“氧化剂"或“还原剂”)。 H2O(l)═H2O(g) △H1=44.0kJ•mol-1 N2(g)+O2(g)═2NO(g) △H2=229.3kJ•mol-1 4NH3(g)+5O2(g)═4NO(g)+6H2O(g) △H2=-906.5kJ•mol-1 4NH3(g)+6NO(g)═5N2(g)+6H2O(l) △H4 (2)合成氨反应是氮肥等工业的基础。己知在298℃时,氮气与氢气反应生成0.2 mol 氨气放出9.22kJ的热量,请写出合成氨反应的热化学方程式: (3)利用NH3的还原性可消除各种氮氧化物的污染,相关热化学方程式如左上: ①1molN2(g)和1mol02(g)的总能量__ _(填“大于”、“小于”或“等于”)2molNO(g)的能量 ②△H4=_ __kJ•mol-1. ③液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如右上图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。该电池的负极电极反应式为 ,其中的离子交换膜需选 (阳离子交换膜、阴离子交换膜)。 (4)下表列出了一些化学键的键能E: 化学键 H﹣H O═O O﹣H E/kJ•mol﹣1 436 x 463 反应H2(g)+O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,则x=__________. 2.如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量浓度(c)随时间变化如图1所示: (1)从反应开始到平衡,氢气的平均反应速率v(H2)=_ _____.500℃达平衡时,CH3OH(g)的体积分数为______,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为______ 反应(填“放热”或“吸热”) (2)500℃该反应的平衡常数为______(保留两位小数),若提高温度到800℃进行,达平衡时,K值______(填“增大”“减小”或“不变”). (3)下列措施中不能使CO2的转化率增大的是______. A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2 C.升高温度 D.使用更有效的催化剂 E.将水蒸气从体系中分离出 F.缩小容器的容积 G.在原容器中充入1molHe (4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______ v(逆)(填“>”“<”或“=”) 3、 某课外活动小组准备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: A电极 B电极 X溶液 甲 Cu Zn H2SO4 乙 Pt Pt CuCl2 丙 Fe Cu ? (1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为_______________。 (2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为________ ___________。实验时应闭合的电键的组合是________(从下列五项中选择所有可能组合,第(3)小题也在这五项中选择)。 A.K1和K2 B.K1和K3 C.K1和K4 D.K2和K3 E.K2和K4 (3)丙同学准备在Fe上镀Cu,选择了用某种盐来配制电镀液,则该盐中应含的阳离子为________,实验时,应闭合的电键的组合是________。 三、计算题(共6分) 将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O(g)+CO(g)⇌H2(g)+CO2(g)达到平衡时,发现有50%的CO转化为CO2.在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,则反应达平衡后,求 (1)达平衡后CO的转化率 (2)混合气体中CO2体积分数.查看更多