2018-2019学年江西省南昌市八一中学、洪都中学七校高二上学期期中考试化学试题(Word版)
2018~2019学年度第一学期高二化学期中联考试卷
命题人:毛勤
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5
第Ⅰ卷(共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列事实能用勒夏特列原理解释的是
A.工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B.合成氨工业中使用铁触媒做催化剂
C.用饱和食盐水除去氯气中氯化氢杂质
D.容器中有2HI(g)H2(g)+I2(g),增大压强颜色变深
2.下列说法不正确的是
A. 一定温度下的焓变在数值上等于变化过程中的等容热效应
B. 升高温度,活化分子百分数增大,化学反应速率一定增大
C. 熵增加且放热的反应一定是自发反应
D. 常温下硝酸铵能够溶于水,因为其溶于水是一个熵增大过程
3. 下列热化学方程式正确的是
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g)ΔH=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a
b
8.某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响图像如下,下列判断正确的是
A. 由图1可知,T1V逆
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
9.工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min
质量/g
温 度/℃
0
1
2
3
4
5
6
250
0.00
1.52
2.80
3.71
4.73
5.60
5.60
300
0.00
2.13
3.45
4.48
4.48
4.48
4.48
下列说法正确的是
A. 250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B. 反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C. 达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D. 反应达到平衡时, 两种条件下反应放出的热量一样多
10.已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)2NO(g) K1=1×10-30
②2H2(g)+O2(g)2H2O(g) K2=2×1081
③2CO2(g)2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g) N2(g)+O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
11.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B.2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D.2 mol A、3 mol B和3 mol C
12.已知相同条件下,下列反应的焓变和平衡常数分别表示为
①2H2O(g)===O2(g)+2H2(g)ΔH1 K1=x
②Cl2(g)+H2(g)===2HCl(g)ΔH2 K2=y
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3 K3=z
则下列关系正确的是
A. ΔH3=ΔH1+2ΔH2 z=xy2 B. ΔH3=ΔH1+ΔH2 z=x+y
C. ΔH3=ΔH1+2ΔH2 z=x﹣y2 D. ΔH3=ΔH1+ΔH2 z=
13.下图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)N2O4(g);△H<0。则以下说法不正确的是
A. 保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B. 打开K一会,再关闭它,向右推动活塞,最后A容器的气体颜色比B的浅
C. 保持活塞位置不变,打开K一会,再关闭它,把A容器加热,A中气体颜色比B中深
D. 打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
14.在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
15.某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:
aA(g)+2B(g)3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
16.在一定温度下,将CO和水蒸气分别为1 mol、3 mol,在密闭容器中反应: CO+H2O(g)CO2+H2,达到平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
A.1.2 mol B.1.5 mol C.1.8 mol D.2.5 mol
第Ⅱ卷(共52分)
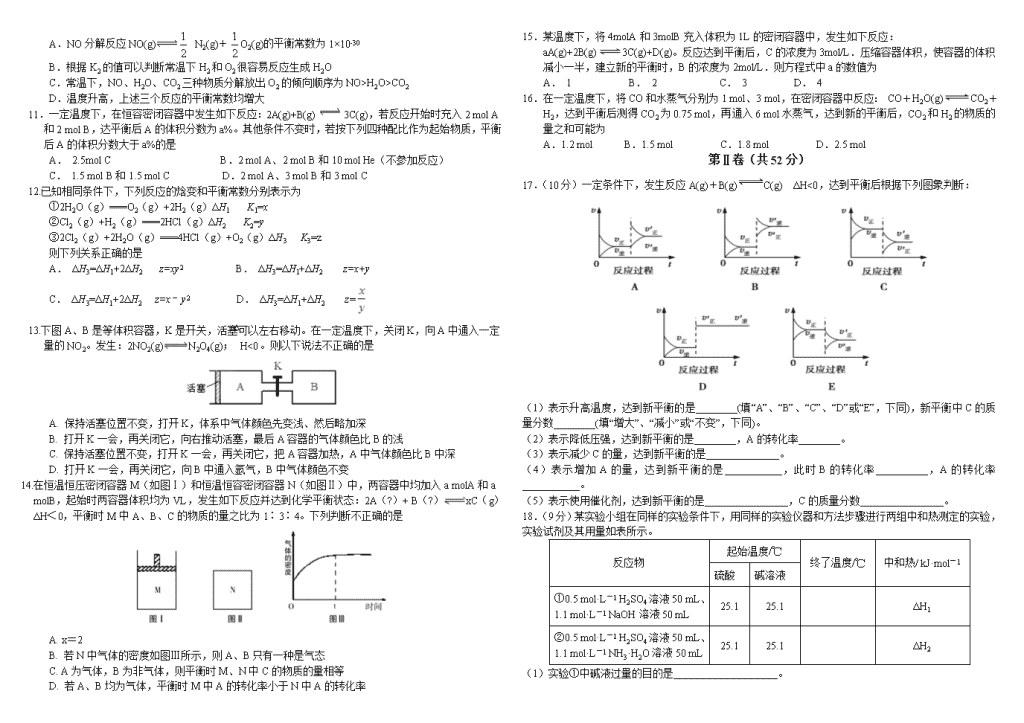
17.(10分)一定条件下,发生反应A(g)+B(g)C(g) ΔH<0,达到平衡后根据下列图象判断:
(1)表示升高温度,达到新平衡的是________(填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数________(填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是________,A的转化率________。
(3)表示减少C的量,达到新平衡的是______________。
(4)表示增加A的量,达到新平衡的是___________,此时B的转化率__________,A的转化率___________。
(5)表示使用催化剂,达到新平衡的是________________,C的质量分数________________。
18.(9分)某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和热测定的实验,实验试剂及其用量如表所示。
反应物
起始温度/℃
终了温度/℃
中和热/ kJ·mol-1
硫酸
碱溶液
①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL
25.1
25.1
ΔH1
②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL
25.1
25.1
ΔH2
(1)实验①中碱液过量的目的是____________________。
(2)甲同学预计ΔH1≠ΔH2,其依据是______________________。
(3)若实验测得①中终了温度为31.8 ℃,则该反应的中和热ΔH1=________(已知硫酸、NaOH溶液密度近似为1.0 g·cm-3,中和后混合液的比热容c=4.18×10-3 kJ·g-1·℃-1)。
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH________(填“偏大”“偏小”或“不变”,下同)。
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q________。
19.(12分)汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g)2NO(g),是导致汽车尾气中含有NO的原因之一。
(1)已知H2或CO可以催化还原NO以达到消除污染的目的。
N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是_________________________
判断该反应自发进行的条件:_______________(填“高温自发”或“低温自发”)
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①则该反应的△H___0(填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、 S2条件
下达到平衡过程中的变化曲线
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反
应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)
的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为_________MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
20.(13分)
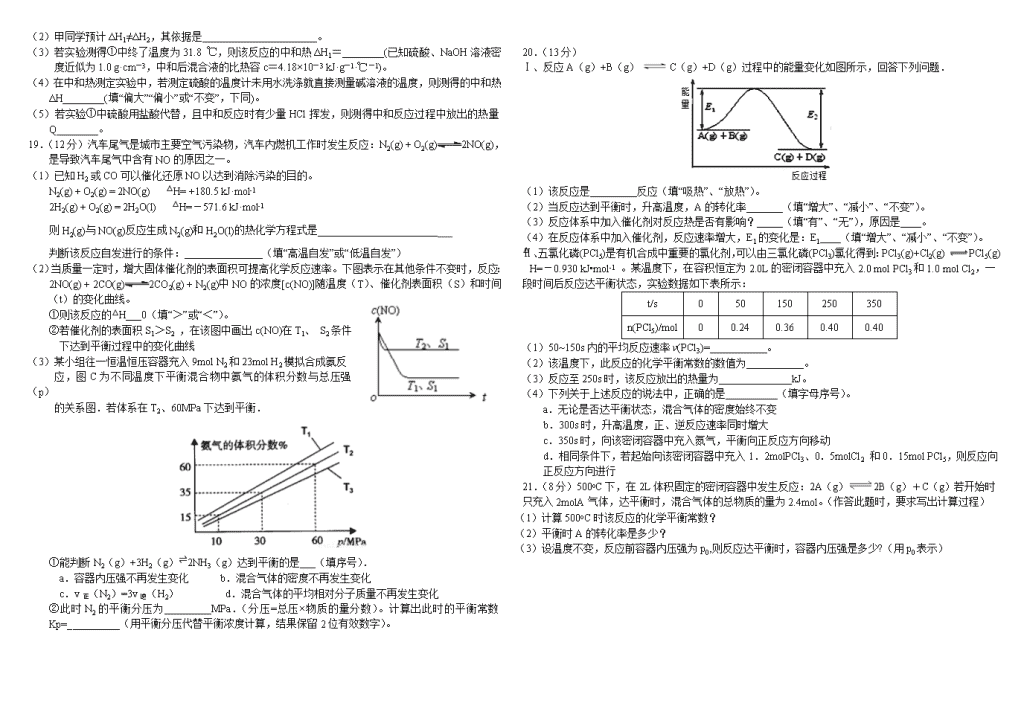
Ⅰ、反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是_________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______(填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____(填“有”、“无”),原因是____。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____(填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s
0
50
150
250
350
n(PCl5)/mol
0
0.24
0.36
0.40
0.40
(1)50~150s内的平均反应速率v(PCl3)=___________。
(2)该温度下,此反应的化学平衡常数的数值为___________。
(3)反应至250s时,该反应放出的热量为______________kJ。
(4)下列关于上述反应的说法中,正确的是__________(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.2molPCl3、0.5molCl2 和0.15mol PCl5,则反应向正反应方向进行
21.(8分)500oC下,在2L体积固定的密闭容器中发生反应:2A(g)2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
高二化学参考答案
题号
1
2
3
4
5
6
7
8
答案
C
A
D
C
A
C
C
C
题号
9
10
11
12
13
14
15
16
答案
B
C
A
A
B
D
B
C
17.(10分) B 减小 C 减小 E A 增大 减小 D 不变
18.(9分)
(1)保证酸完全反应,减少实验误差(1分)
(2)NH3·H2O是弱碱,其电离过程会吸收热量
(3)-56 kJ/mol
(4)偏大
(5)偏小
19.(12分)
(1)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H=-752.1 kJ·mol-1 低温自发
(2)①< ②
(3)①bd ②9 0.043
20.(13分)
Ⅰ、(1) 放热 (2) 减小
(3) 无 催化剂不改变反应物总能量与生成物总能量之差即反应热不变
(4)减小 (每空各1分)
Ⅱ、(每空各2分)
(1)6×10-4 mol/(L•s)或0.0006mol/(L•s) (2) 0.83或5/6
(3)0.372 (4)abd
21. (共8分)
(1)0.089(2)40%(3)1.2p0
解:(1)2A(g)2B(g)+C(g)
起始:1mol/L 0 0
变化:x x 1/2x
平衡:1—x x 1/2x
依题意有1—x+x+1/2x=1.2mol/L解得x=0.4mol/L(2分)
(2分)
(2)A的转化率==40%(2分)
(3)(2分)
高二化学参考答案
题号
1
2
3
4
5
6
7
8
答案
C
A
D
C
A
C
C
C
题号
9
10
11
12
13
14
15
16
答案
B
C
A
A
B
D
B
C
17.(10分) B 减小 C 减小 E A 增大 减小 D 不变
18.(9分)
(1)保证酸完全反应,减少实验误差(1分)
(2)NH3·H2O是弱碱,其电离过程会吸收热量
(3)-56 kJ/mol
(4)偏大
(5)偏小
19.(12分)
(1)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H=-752.1 kJ·mol-1 低温自发
(2)①< ②
(3)①bd ②9 0.043
20.(13分)
Ⅰ、(1) 放热 (2) 减小
(3) 无 催化剂不改变反应物总能量与生成物总能量之差即反应热不变
(4)减小 (每空各1分)
Ⅱ、(每空各2分)
(1)6×10-4 mol/(L•s)或0.0006mol/(L•s) (2) 0.83或5/6
(3)0.372 (4)abd
21. (共8分)
(1)0.089(2)40%(3)1.2p0
解:(1)2A(g)2B(g)+C(g)
起始:1mol/L 0 0
变化:x x 1/2x
平衡:1—x x 1/2x
依题意有1—x+x+1/2x=1.2mol/L解得x=0.4mol/L(2分)
(2分)
(2)A的转化率==40%(2分)
(3)(2分)