- 2021-06-05 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西专用2020版高考化学二轮复习非选择题专项训练4物质结构与性质选修含解析
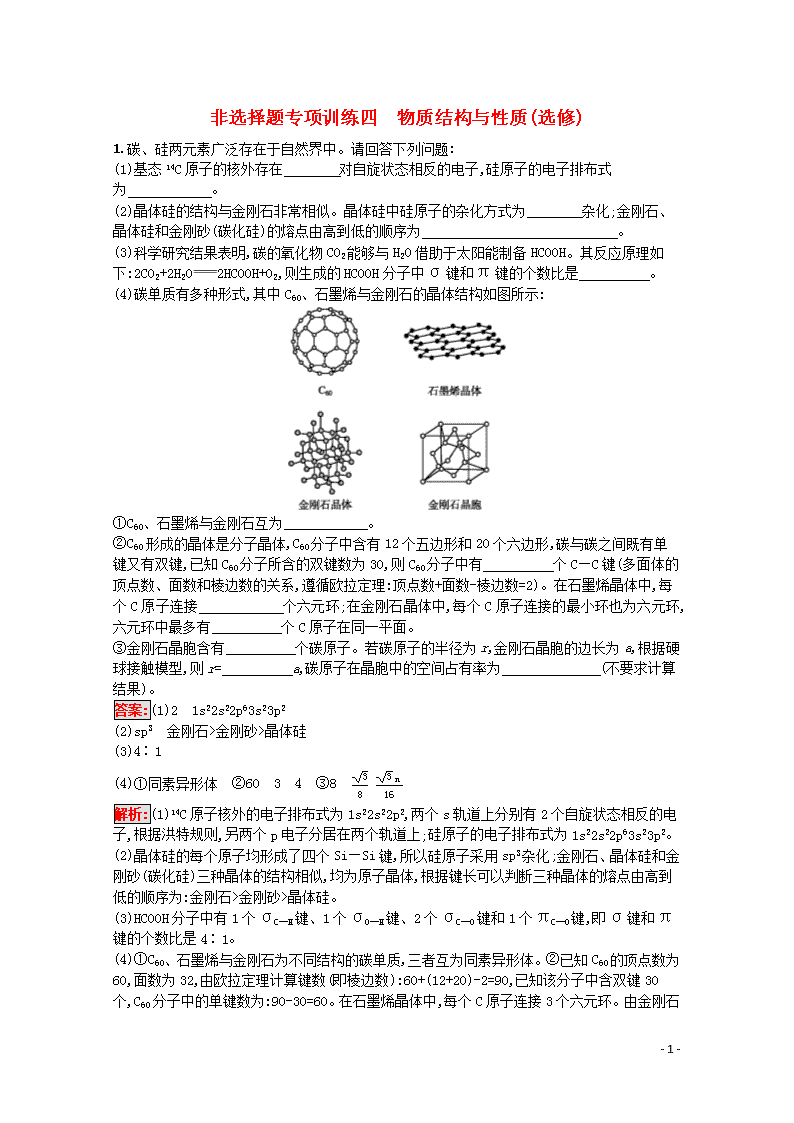
非选择题专项训练四 物质结构与性质(选修) 1.碳、硅两元素广泛存在于自然界中。请回答下列问题: (1)基态14C原子的核外存在 对自旋状态相反的电子,硅原子的电子排布式为 。 (2)晶体硅的结构与金刚石非常相似。晶体硅中硅原子的杂化方式为 杂化;金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为 。 (3)科学研究结果表明,碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH。其反应原理如下:2CO2+2H2O2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是 。 (4)碳单质有多种形式,其中C60、石墨烯与金刚石的晶体结构如图所示: ①C60、石墨烯与金刚石互为 。 ②C60形成的晶体是分子晶体,C60分子中含有12个五边形和20个六边形,碳与碳之间既有单键又有双键,已知C60分子所含的双键数为30,则C60分子中有 个C—C键(多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2)。在石墨烯晶体中,每个C原子连接 个六元环;在金刚石晶体中,每个C原子连接的最小环也为六元环,六元环中最多有 个C原子在同一平面。 ③金刚石晶胞含有 个碳原子。若碳原子的半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= a,碳原子在晶胞中的空间占有率为 (不要求计算结果)。 答案:(1)2 1s22s22p63s23p2 (2)sp3 金刚石>金刚砂>晶体硅 (3)4∶1 (4)①同素异形体 ②60 3 4 ③8 38 3π16 解析:(1)14C原子核外的电子排布式为1s22s22p2,两个s轨道上分别有2个自旋状态相反的电子,根据洪特规则,另两个p电子分居在两个轨道上;硅原子的电子排布式为1s22s22p63s23p2。 (2)晶体硅的每个原子均形成了四个Si—Si键,所以硅原子采用sp3杂化;金刚石、晶体硅和金刚砂(碳化硅)三种晶体的结构相似,均为原子晶体,根据键长可以判断三种晶体的熔点由高到低的顺序为:金刚石>金刚砂>晶体硅。 (3)HCOOH分子中有1个σC—H键、1个σO—H键、2个σC—O键和1个πC—O键,即σ键和π键的个数比是4∶1。 (4)①C60、石墨烯与金刚石为不同结构的碳单质,三者互为同素异形体。②已知C60的顶点数为60,面数为32,由欧拉定理计算键数(即棱边数):60+(12+20)-2=90,已知该分子中含双键30个,C60分子中的单键数为:90-30=60。在石墨烯晶体中,每个C原子连接3个六元环。由金刚石 - 5 - 的晶体结构图可以看出,六元环中最多有4个C原子在同一平面。③由金刚石的晶胞结构可看出,碳原子位于晶胞的顶点、面心和体内,故晶胞中含有的碳原子数目为18×8+12×6+4=8。根据硬球接触模型可知,在立方体的对角线上碳原子紧密接触,故8r=3a,则r=38a,8个碳原子的体积为8×43πr3=8×43π×(38a)3=3πa316,故原子利用率为3π16。 2.开发新型储氢材料是氢能利用的重要研究方向。 (1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。 ①基态Ti3+的未成对电子有 个。 ②LiBH4由Li+和BH4-构成,BH4-呈四面体构型,LiBH4中不存在的作用力有 (填标号)。 A.离子键 B.共价键 C.金属键 D.配位键 ③Li、B、H元素的电负性由大到小排列顺序为 。 (2)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为 。 答案:(1)①1 ②C ③H>B>Li (2)LaNi5 解析:(1)①基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,其未成对电子数是1;②Li+和BH4-之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键,故选C;③非金属性越强其电负性越大,非金属性最强的是H,其次是B,最小的是Li,所以Li、B、H的电负性由大到小排列顺序为H>B>Li。 (2)La的原子个数=18×8=1,Ni的原子个数=8×12+1=5,所以该合金的化学式为LaNi5。 3.H、C、N、O都属于自然界中常见的非金属元素。 (1)O、C、N三种元素中第一电离能最大的元素的基态原子的电子排布式为 。 (2)O22+与N2互为等电子体,O22+的电子式可表示为 ,O22+中σ键数目和π键数目之比为 。 (3)乙二胺(结构简式为H2N—CH2—CH2—NH2)分子中的碳原子的杂化轨道类型为 , Cu2+与乙二胺可形成配离子,该配离子中含有的化学键类型有 (填字母)。 A.配位键 B.极性键 C.离子键 D.非极性键 (4)CO和N2的键能数据如下表所示(单位:kJ·mol-1): 物质 化学键 A—B(A) AB(A) A≡B(A) - 5 - CO 357.7 798.9 1 071.9 N2 154.8 418.4 941.7 结合数据说明CO比N2活泼的原因: 。 (5)C、N元素形成的新材料的晶胞具有如图所示结构,该晶体硬度超过目前世界上最硬的金刚石,成为超硬新材料,若晶胞边长为a cm,则该晶体的密度是 g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。 答案:(1)1s22s22p3 (2)[∶O︙︙O∶]2+ 1∶2 (3)sp3 ABD (4)虽然C≡O键的键能高达1 071.9 kJ·mol-1,比N≡N键的键能大,但是断裂1 mol CO分子中第一个π键需要的能量只有273.0 kJ,而断裂1 mol N2分子中第一个π键需要的能量是523.3 kJ,CO的第一个π键更易断裂 (5)92a3NA 解析:(1)由于氮原子2p轨道上的电子处于半充满状态,失去1个电子需要较高能量,所以第一电离能在O、C、N三种元素中最大,C的原子半径大于O的,失去1个电子所需能量低于O失去1个电子所需能量,故第一电离能大小顺序为C查看更多