2019届二轮复习化学平衡作业(全国通用)(1)
化学平衡
1、下列有关化学反应速率和限度的说法中,不正确的是( )
A.已知工业合成氨的正反应方向放热,所以升温正反应速率降低,逆反应速率升高
B.实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快
C.2SO2+O22SO3反应中,SO2的转化率不能达到100%
D.实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
2、常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
3、下列事实不能用勒夏待列原理解释的是( )
A.工业合成氨,控制温度在 700K 左右
B.久置的氯水 pH 值变小,颜色变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.开启啤酒瓶后,瓶中泛起大量泡沫
4、在一定温度下的密闭容器中,加入1mol CO和1mol H2O发生反应CO(g)+H2O(g)CO2(g)+H2(g),达到平衡时测得n(H2)=0.5mol,下列说法不正确的是( )
A.在该温度下,反应的平衡常数K=1
B.平衡常数与反应温度无关
C.CO的平衡转化率为50%
D.平衡时n(H2O)=0.5mol
5、下列设计的实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
探究化学反应的限度
取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5〜6滴,充分反应.可根据溶液中既含I2又含I-的实验事实判断该反应足可逆反应
B
探究浓度对化学反应速率的影响
用两支试各取5moL 0.1mol/L的KMnO4溶液.分別加入2mL 0.1mol/L 和2mL 0.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间
C
证明海带中含有碘元素
将海带剪碎、加蒸馏水浸泡,取滤液于试管中,加几滴稀疏酸和1mL H2O2,再加入几滴淀粉溶液.溶液变蓝
D
验证CH3COONa溶液中存在水解平衡
取CH3COONa溶液于试中并加入几滴酚酞试液,再加入醋酸铵固体(其水溶液呈中性).观察溶液颜色变化
6、在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
A.该反应的ΔH>0
B.若该反应在t1、t2℃时的平衡常数分别为K1、K2,则K1
v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
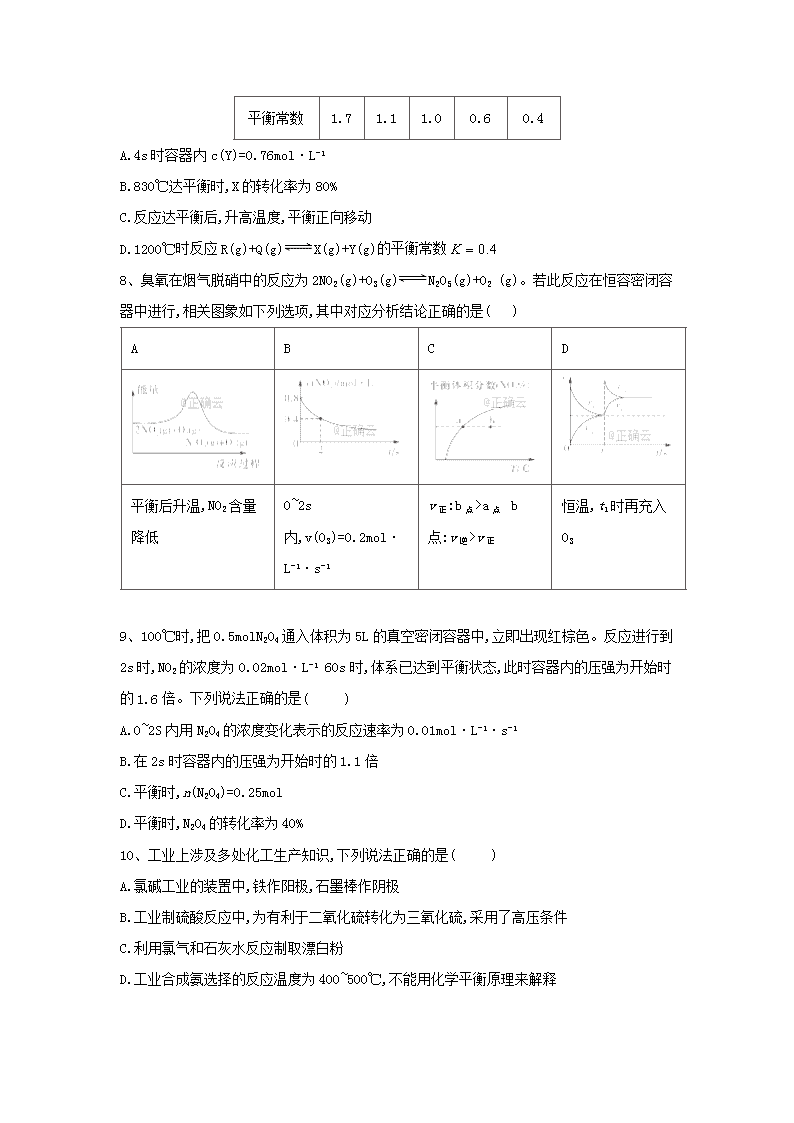
7、已知反应X(g)+Y(g)R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2mol X和0.8mol Y,反应初始4s内v(X)=0.005mol/(L·s)。下列说法正确的是( )
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
A.4s时容器内c(Y)=0.76mol·L-1
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应R(g)+Q(g)X(g)+Y(g)的平衡常数
8、臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)N2O5(g)+O2 (g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
A
B
C
D
平衡后升温,NO2含量降低
0~2s内,v(O3)=0.2mol·L-1·s-1
v正:b点>a点
b点:v逆>v正
恒温,t1时再充入O3
9、100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1 60s时,体系已达到平衡状态,此时容器内的压强为开始时的1.6倍。下列说法正确的是( )
A.0~2S内用N2O4的浓度变化表示的反应速率为0.01mol·L-1·s-1
B.在2s时容器内的压强为开始时的1.1倍
C.平衡时,n(N2O4)=0.25mol
D.平衡时,N2O4的转化率为40%
10、工业上涉及多处化工生产知识,下列说法正确的是( )
A.氯碱工业的装置中,铁作阳极,石墨棒作阴极
B.工业制硫酸反应中,为有利于二氧化硫转化为三氧化硫,采用了高压条件
C.利用氯气和石灰水反应制取漂白粉
D.工业合成氨选择的反应温度为400~500℃,不能用化学平衡原理来解释
11、一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
A.M点的正反应速率v正大于N点的逆反应速率v逆
B.若投料比n(H2):n(CO2)=4:1,则图中M点乙烯的体积分数为5.88%
C.250℃,催化剂对CO2平衡转化率的影响最大
D.当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
12、甲醇被称为21世纪的新型燃料,工业上可以用CH4和H2O为原料来制备甲醇.
(1).将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g)+H2O(g)CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图甲:
①已知100℃,压强为P1时,达到平衡所需的时间为5min,则用H2表示的平均反应速率为__________.
②在其它条件不变的情况下升高温度,化学平衡常数将__________(填“增大”“减小”或“不变”).
③图中的P1__________P2(填“<”、“>”或“=”),在100℃,压强为P1时平衡常数为__________.
④保持反应体系100℃,压强为P1,5min后再向容器中冲入H2O、H2各0.5mol,化学平衡将向__________移动(填“向左”“向右或“不”).
(2).在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发发生反应
Ⅱ:CO(g)+2H2(g)CH3OH(g)
①该反应的ΔΗ__________0,ΔS__________0(填“<”、“>”或“=”).
②若容器容积不变,下列措施可以提高CO转化率的是__________.
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2.
13、甲烷是重要的化工原料,当前,科学家还在探索甲烷在环保、化工领域内的新应用
(1).利用甲烷可减少温室气体排放:CH4(g)+CO2(g)2CO(g)+2H2(g),为研究此反应中CH4的平衡转化率与温度、压强的关系,在体积为2L的密闭容器中通入0.2mol CH4和0.2mol CO2,得到如图所示的相关数据。
①下列事实能说明该反应已达到平衡状态的是__________(填序号)。
a.容器内气体的总物质的量不再发生变化 b.v正(CH4) =2v逆(H2) c.混合气体的平均相对分子质量不发生变化 d.CH4(g)与CO2的物质的量之比为1 :1
②图中,p1,p2,p3,p4中,压强最小的是__________
③图中X点时反应的平衡常数为__________[来源:]
(2).用CH4可还原Fe2O3制取“纳米铁”,其原理为Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) △H>0
①在2L的密闭容器中进行该反应,1min后达到平衡,生成2.24g纳米铁,则该段时间内以CH4的浓度变化表示的平均反应速率为__________
②如图表示此反应在不同温度条件下达到平衡时的状态,纵坐标表示的物理量可以是__________ (填序号)。
A.CH4的正反应速率 B.CH4的转化率 C.纳米铁的产率 D.CH4的体积分数
答案以及解析
1答案及解析:
答案:A
2答案及解析:
答案:B
解析:A、平衡常数只与温度有关,与浓度无关,A错误;
B、50时,Ni(CO)4以气态存在,有利于分离,从而促使平衡正向移动,B正确;
C、230时,Ni(CO)4分解的平衡常数为5×106,可知分解率较高,C错误;
D、平衡时,4v生成[Ni(CO)4]=v生成(CO),D错误。
故选B。[来源:]
3答案及解析:
答案:A
4答案及解析:
答案:B
解析: CO(g)+H2O(g)CO2(g)+H2(g)[来源:][来源:]
起始/mol: 1 1 0 0
转化/mol: 0.5 0.5 0.5 0.5
平衡/mol: 0.5 0.5 0.5 0.5
由方程式及以上数据判断可得,A、C、D项正确。平衡常数与反应温度有关,B项错误。
5答案及解析:
答案:D
解析:KI与FeCl3发生氧化还原反应,反应的离子方程式为2Fe3++2I-2Fe2++I2,因为KI过量,所以溶液中存在I-和I2,不能说明反应是可逆反应,A错误;
酸性高锰酸钾溶液与草酸反应的离子方程式为2MnO4-+5H2C2O4+6H+8H2O+10CO2↑+2Mn2+,题中高锰酸钾过量,溶液不褪色,故B错误;
将海带剪碎后加蒸馏水浸泡,海带中的碘元素不能进入溶液中,应剪碎后加热灼烧,然后加蒸馏水浸泡,过滤,故C错误;
CH3COONa溶液中存在水解平衡:CH3COO-+H2OCH3COOH+OH-,加入酚酞试液,溶液变红,再加入醋酸铵固体,醋酸铵溶液呈中性,CH3COO-的浓度增大.水解平衡向正反应方向移动, 溶液颜色加深,故D正确
6答案及解析:
答案:C
解析:由图可知.随温度升高,NO的浓度升高,说明升高温度平衡逆向移动,则该反应为放热反应,△H<0,A项错误;升高温度,平衡逆向移动,平衡常数减小,则K1>K2,B项错误;在t2时,若反应体系处于状态D,则此时未达到平衡状态,反应正向进行,则此时v正>v逆,C项正确;温度越高,压强越大,则p(C)>p(D)=p(B),D项错误。
7答案及解析:
答案:B
解析:A.反应初始4内,速率之比等于化学计量数之比,所以,则4内,的起始浓度为,故4时,故A错误;B.设平衡时的浓度变化量为,则:
开始(): 0.1 0.4 0 0
变化():
平衡():
故,解得
所以平衡时的转化率为,故B正确;C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;D.1200℃时反应的平衡常数值为0.4,所以1200℃时反应的平衡常数的值为,故D错误;故选B。
8答案及解析:
答案:C
解析:根据图示可知,该反应的正反应是放热反应,当反应达到平衡后升高温度,根据平衡移动原理,化学平衡向吸热的逆反应方向移动,含量增大,错误;B.根据图示可知,在0~2内,减小0.4,则根据反应方程式中物质的关系可知,变化的浓度是0.2,所以该时间内的化学反应速率是,错误;C.升高温度,化学反应速率加快,由于温度:,所以化学反应速率:,正确;D.恒温时,向容器中再充入,由于增大了反应物的浓度,同时也增大了体系的压强,突然增大, 在这一瞬间不变,由于,所以化学平衡向正反应方向移动,错误。
9答案及解析:
答案:B
解析:N2O4和NO2之间存在转化关系:
N2O4(g)2NO2(g)
起始量/mol 0.5 0
变化量/mol 0.05 0.02×5
2s时量/mol 0.5-0.05 0.02×5
,
A项错误;此时气体总的物质的量为0.5mol-0.05mol+0.02mol·L-1×5L=0.55 mol,则2s时容器内的压强与开始时容器内的压强之比为=0.55:0.5= 11:10,B项正确;达到平衡状态之比为p2s:p始=0.55:0.5=11:10,B项正确;达到平衡状态时,设有x mol N2O4参与反应,则
N2O4(g)2NO2(g)
起始量/mol 0.5 0
变化量/mol x 2x
平衡量/mol 0.5-x 2x
达到平衡状态时,气体总的物质的量为0.5mol-x mol+2x mol=(0.5+x)mol,则
解得x=0.3,平衡体系中含0.2 mol ,C项错误;平衡时,的转化率为,D项错误;
10答案及解析:
答案:D
解析:A项,氯碱工业的装置中,铁作阴极,石墨棒作阳极,错误;B项,工硫酸反应中,采用常压条件,常压下二氧化硫的转化率就已经很高,增大压强对设备要求高,不经济,错误;C项,利用氯气和石灰乳反应制取漂白粉,错误;D项,升高温度可使反应速率加快,缩短达平衡的时间,但合成氨正反应方向为放热反应,温度升高,平衡逆向移动,正确;
11答案及解析:
答案:B
解析:
A项,化学反应速率随温度的升高而加快,由图可得,当温度高于250℃时,催化剂的催化效率随温度的升高而降低,所以M点的正反应速率v正有可能小于N点的逆反应速率v逆,错误;设开始投料n(H2)为4mol,则n(CO2)为1mol,如图当在M点平衡时二氧化碳的转化率为50%,列三段式得:
6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)
起始(mol): 4 1 0 0
转化(mol): 1.5 0.5 0.25 1
平衡(mol): 2.5 0.5 0.25 1
所以乙烯的体积分数为,正确;C项,催化剂不影响平衡转化率,只影响化学反应速率,错误;D项,根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率降低,则说明平衡逆向移动,但催化剂与化学平衡没有关系,并不是平衡逆向移动导致催化剂的催化效率降低,错误。故选B项。
12答案及解析:
答案:1.0.030mol·L-1·min-1; 增大; <;>-2; 向左
2.<;><; bd>
13答案及解析:
答案:1.①ac
②p1
③1.64
2.①0.03mol·L-1·min-1
②D
解析:1.①反应未达到平衡时,反应无论正向还是逆向进行,容器内气体的总物质的量都会发生变化,故气体的总物质的量不再发生变化能说明反应已达到平衡状态,a项符合题意;当2v正(CH4)=v逆(H2)时,正、逆反应速率相等,反应达到平衡,故b项不符合题意;密闭容器中气体的总质量始终不变,正方向气体的总物质的量增大,故气体的平均相对分子质量减小,不变时,反应达到平衡状态,故c项符合题意;CO2与CH4的初始物质的量之比1:1反应中消耗的物质的董之比为1:1.反应中CO2和CH4的物质的量之比始终为1:1,故d项不符合题意。
②该反应正反应是气体体积增大的反应,减小压强平衡向正反应方向进行,根据图像可知,相同温度下,p1压强下甲烷的转化率最高
2.
②温度升高,CH4的正反应速率增大,平衡正向移动,CH4的转化率增大,纳米铁的产率增大,CH4的体积分数减小,故D正确