- 2021-06-04 发布 |
- 37.5 KB |
- 84页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习鲁科版专题14物质的分离提纯与制备课件63(84张)
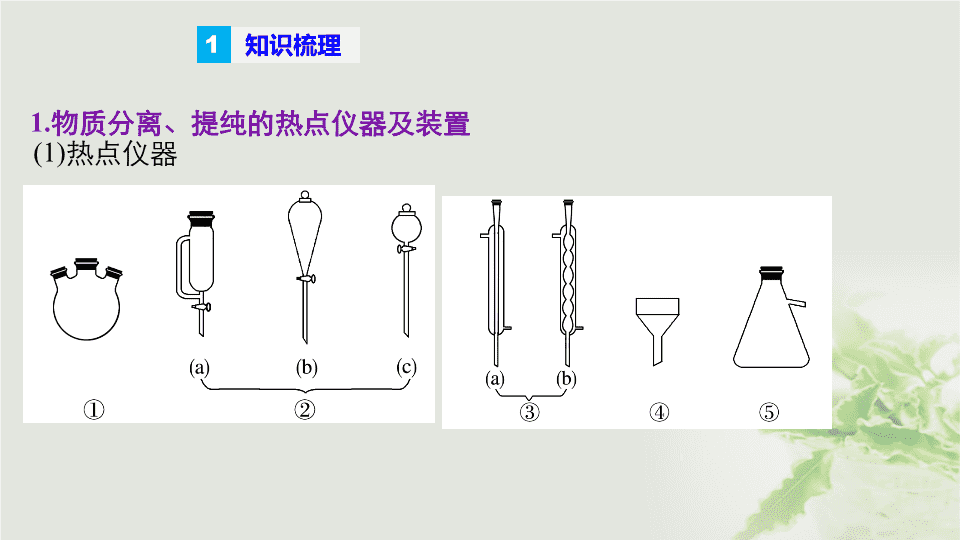
专题 十四 物质的分离、提纯与制备 考点一 物质 制备与分离、提纯的融合 知识梳理 1 1. 物质分离、提纯的热点仪器及装置 (1) 热点仪器 ① 三颈烧瓶是一种常用的化学玻璃仪器,它有三个口, 可以 同时 加入多种反应物,或是加冷凝管、温度计、搅拌器等,常用于物质的制备、分离和提纯。 a. 通常用于需要控制温度的化学反应,中间孔装搅拌杆,一个侧孔装温度计,另一个滴加反应物料。 b. 物质的分离和提纯,三颈烧瓶的三颈中间孔可以插上回流管,右侧可插入温度计,左侧主要是用来添加药品。 ② 分液漏斗 ( 滴液漏斗 ) ,一般为向烧瓶 ( 带磨口塞 ) 中滴加液体,其中 (a) 能起到平衡气压的作用。 ③ 冷凝管,注意进出水方向 ( 下口进,上口出 ) 。 ④ 布氏漏斗是中间带有多孔瓷板的白色瓷质漏斗,适用于晶体或沉淀等固体与大量溶液分离的实验中,常用于抽滤 。 ⑤ 吸滤瓶,与布氏漏斗组成减压过滤装置,用于接收液体。 (2) 热点组合装置 ① 蒸馏装置 ② 过滤装置 ③ 减压过滤装置 为了加快过滤速度,得到较干燥的沉淀,可进行减压过滤 ( 也称抽滤或吸滤 ) 。 减压 过滤装置如上图所示。装置中抽气泵给吸滤瓶减压,造成瓶内与布氏漏斗液面上的压力差,从而加快过滤速度。吸滤瓶用于承接滤液。 布氏漏斗上有许多小孔,漏斗管插入单孔橡胶塞与吸滤瓶相接。 注意 布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤。 ④ 热过滤装置 ⑤ 蒸发结晶装置 ⑥ 分液装置 ⑦ 纸层析实验示意图 ⑧ 搅拌滴加回流反应装置 2. 物质分离、提纯的思维方向 (1) 固体混合物的分离、提纯 ① 溶解过滤法 ( 如分离 MnO 2 和 KCl 的混合物 ) 。 ② 溶解结晶法 ( 如分离 KNO 3 和 NaCl 的固体混合物 ) 。 ③ 升华法 ( 如分离 I 2 、 NaCl 或 NH 4 Cl 、 NaCl 的混合物 ) 。 ④ 加热灼烧法 ( 如除去 Na 2 CO 3 中的 NaHCO 3 ) 。 ( 2) 气体的分离、提纯 ① 混合法:如用水洗法除去 NO 中的 NO 2 、 H 2 中的 HCl 等。 ② 加热法:如用灼热铜除去 N 2 中的 O 2 。 ③ 吸收法:如用碱石灰除去气体中的水蒸气,用 Na 2 O 2 除去 O 2 中的 CO 2 等。 (3) 液体的分离、提纯 ① 萃取法; ② 分液法; ③ 沉淀法; ④ 生成气体法 ( 如 NaCl 溶液中的 Na 2 CO 3 杂质用盐酸除去 ) ; ⑤ 氧化法或还原法 ( 如 FeCl 3 中的 FeCl 2 用 Cl 2 除去, FeCl 2 中的 FeCl 3 用铁粉除去 ) ; ⑥ 转化法 ( 如 NaHCO 3 溶液中的 Na 2 CO 3 用通 CO 2 的方法除去 ) ; ⑦ 电解法 ( 如稀硫酸中的盐酸可用电解法除去 ) 等 。 3 . 纸层析法的原理及实验操作 (1) 基本原理 纸层析以滤纸为惰性支持物。滤纸纤维上的羟基具有亲水性,它所吸附的水作为固定相,不与水混溶的有机溶剂作为流动相。 样品中各组分在水或有机溶剂中的溶解能力不同,各组分在两相中有不同的分配现象。亲脂性强的成分在流动相中分配得多,随流动相移动的速度快;而亲水性强的成分在固定相中分配得多,随流动相移动的速度慢。 ( 2) 应用举例 —— 用纸层析法分离铁离子和铜离子 ① 纸层析法分离 Fe 3 + 、 Cu 2 + 的原理 Fe 3 + 、 Cu 2 + 在滤纸上随丙酮等展开的速度不同,展开后两种离子的富集部分不同,从而达到分离的目的。 ② Fe 3 + 、 Cu 2 + 的显色 反应 吸附有 Fe 3 + 、 Cu 2 + 的滤纸经氨薰后显色: Cu(OH) 2 能溶于过量氨水中,生成 Cu(NH 3 )( 呈深蓝色 ) ; Fe(OH) 3 ( 呈红褐色 ) 不溶于过量氨水中 。 Fe 3 + 、 Cu 2 + 的显色是利用 Fe(OH) 3 、 Cu(NH 3 ) 的 特征颜色 。 Fe 3 + 遇氨水反应生成红褐色沉淀: Fe 3 + + 3NH 3 ·H 2 O == =Fe(OH) 3 ↓ + 3NH 。 Cu 2 + 遇氨水反应生成深蓝色溶液: Cu 2 + + 4NH 3 ·H 2 O == =Cu(NH 3 ) + 4H 2 O 。 ③ 操作步骤: a. 装置制作 —— 裁纸 b. 点样 —— 点层析试样 c. 配制展开剂 d. 层析操作 e. 显色反应 题组集训 2 题组一 热点仪器、热点操作的考查 1 . 用 布氏漏斗和吸滤瓶接抽水泵过滤沉淀后,正确的操作是 ( ) A. 先关水龙头,拔下抽滤瓶上的橡皮管,再取下布氏漏斗 B. 先取下布氏漏斗,再关上水龙头 C. 先将沉淀和滤纸一起取出,再关上水龙头 D. 先拔下抽滤瓶上的橡皮管,关上水龙头,再取下布氏漏斗 1 2 3 4 5 6 7 8 9 解析 解析 抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快。用布氏漏斗和吸滤瓶接抽气泵过滤沉淀后,先拔下抽滤瓶上的橡皮管,关上水龙头,再取下布氏漏斗。 1 2 3 4 5 6 7 8 9 2. 下列 实验装置不适用于物质分离的是 ( ) 解析 1 2 3 4 5 6 7 8 9 解析 A 项,该装置是分离提纯装置,不符合题意 ; B 项,该装置是升华装置,不符合题意 ; C 项,该装置可用于纸层析法,不符合题意 ; D 项,该装置不能用于物质的分离,正确。 1 2 3 4 5 6 7 8 9 3 . 下列 关于实验原理或操作的叙述中,正确的是 ( ) A. 海带中碘的提取实验中,将海带灰溶于水,过滤后在滤液中加入 CCl 4 即 可萃取 B. 减压过滤可以过滤胶状沉淀或颗粒太小的沉淀 C. 用纸层析法分离 Cu 2 + 和 Fe 3 + ,滤纸上端呈棕黄色,说明 Fe 3 + 在 固定相 中 分配的更多 D. 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 解析 1 2 3 4 5 6 7 8 9 解析 A 项,海带中碘元素以碘离子存在,应该先将碘离子转化为碘单质,然后萃取得到碘,错误; B 项,此法可加速过滤,并使沉淀抽吸得较干燥,但不宜过滤胶状沉淀和颗粒太小的沉淀,因为胶状沉淀易穿透滤纸,颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,错误; C 项,用纸层析法分离 Cu 2 + 和 Fe 3 + ,滤纸上端呈棕黄色,说明 Fe 3 + 在流动相中分配的更多,随流动相移动的速度快一些,错误; 解析 1 2 3 4 5 6 7 8 9 D 项,纸层析法中要求流动相溶剂对分离物质应有适当的溶解度,由于样品中各物质分配系数不同,因而扩散速度不同,所以纸层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑,如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败,正确。 1 2 3 4 5 6 7 8 9 解析 4. 物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节。下列有关叙述中,不正确的是 ( ) A. 乙酸乙酯中混有乙酸,可选用饱和 Na 2 CO 3 溶液洗涤,然后将两层液体分开 B. 在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓 (NH 4 ) 2 SO 4 溶液,然后 将所得沉淀滤出,即得较纯的蛋白质 C. 油脂的提纯中,可将油脂加入浓 NaOH 溶液中加热,然后过滤,滤出的溶液 即为较纯的油脂 D. 甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取 蔗糖前应先加入适量的活性炭,搅拌、过滤,蒸发结晶,即得较纯的蔗糖 1 2 3 4 5 6 7 8 9 解析 A 项,乙酸可以和碳酸钠反应生成乙酸钠的水溶液,但是乙酸乙酯在饱和碳酸钠中的溶解度极小,也不溶于水,这样乙酸乙酯和醋酸钠溶液分层,可以采用分液法来分离,正确; B 项,饱和 (NH 4 ) 2 SO 4 溶液能使蛋白质发生盐析,且为可逆过程,能用于蛋白质的分离提纯,正确; C 项,油脂是高级脂肪酸甘油酯,在碱性条件下能发生水解生成高级脂肪酸和甘油,则加入浓 NaOH 溶液中加热,然后过滤,不能得到较纯的油脂,错误; D 项,甘蔗中含蔗糖,能溶于水,加入活性炭利用其吸附性除去杂质,则制取蔗糖前应先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖 ,正确。 1 2 3 4 5 6 7 8 9 5. 下列有关实验说法正确的是 ( ) A. 在 “ 阿司匹林的合成 ” 实验中,把从盐酸中析出的晶体进行抽滤,用乙醇 洗涤晶体 1 ~ 2 次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量, 计算产率 B. 制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜 为止,不能将溶液全部蒸干 C. 晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高, 或溶剂的蒸发速度越快,析出的晶粒就越细大 D. 从溴水中提取单质溴时,能用无水乙醇代替 CCl 4 解析 题后反思 1 2 3 4 5 6 7 8 9 解析 A 项,在 “ 阿司匹林的合成 ” 实验中,把从盐酸中析出的晶体进行抽滤,用冷水洗涤晶体 1 ~ 2 次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率,错误; B 项,蒸发操作不能直接蒸干,以防止温度过高而导致分解而变质,正确; C 项,晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发速度越快,析出的晶粒就越细小,错误; D 项,乙醇和水互溶,所以不能作萃取剂,则乙醇不能代替四氯化碳,但可以用苯代替,错误。 题后反思 1 2 3 4 5 6 7 8 9 1. 物质的分离与提纯的方法很多,如升华、蒸馏、萃取、重结晶、色谱分离、离子交换分离、膜分离技术等。纸层析法属于其中的色谱分离技术,是分离微量物质的常用方法之一。 2. 在分离或提纯操作中,应注意以下两点: (1) 如果被分离的物质转变为其他物质,应设法将其恢复原状; (2) 由于反应终点较难控制,为使离子沉淀完全,所加试剂常常是过量的,而由过量试剂引入的新杂质亦必须除尽。 3. 在理解纸层析法原理时,注意区分 “ 固定相 ” 、 “ 流动相 ” 、 “ 分配 ” 等概念。纸层析分离铁离子、铜离子的实验中, “ 固定相 ” 是滤纸纤维上所吸附的水, “ 流动相 ” 是作为展开剂的有机溶剂。 题后反思 1 2 3 4 5 6 7 8 9 题 组二 基本操作与无机物制备的融合 6 . 某 废催化剂含 58.2% 的 SiO 2 、 21.0% 的 ZnO 、 4.50% 的 ZnS 和 12.8% 的 CuS 及少量的 Fe 3 O 4 。某同学用 15.0 g 该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题: 1 2 3 4 5 6 7 8 9 已知: ZnS 与稀硫酸反应,且化合价不变; CuS 既不溶解于稀硫酸,也不与稀硫酸反应。 (1) 在下列装置中,第一次浸出反应装置最合理的 ________( 填标号 ) 。 解析 第一次 浸出时加入的 0.5 mol·L - 1 稀硫酸会与 ZnS 反应产生 H 2 S 气体,故应有尾气吸收装置,选 D 。 解析 1 2 3 4 5 6 7 8 9 (2) 滤液 1 中含有 Fe 2 + ,选用提供的试剂进行检验,检验方法如下: __________________________________________________________ 。 ( 提供的试剂:稀盐酸、 KSCN 溶液、 KMnO 4 溶液、 NaOH 溶液、碘水 ) 取少量滤液 1 ,滴加高锰酸钾溶液,若褪色,则证明有亚铁离子 解析 因 滤液 1 中既有 Fe 3 + 也有 Fe 2 + ,故利用 Fe 2 + 的还原性来检验,碘水颜色变化不明显,用酸性 KMnO 4 溶液,若褪色则证明含有 Fe 2 + 。 解析答案 1 2 3 4 5 6 7 8 9 (3) 本实验要用到抽滤,设所用的洗涤剂为 X ,抽滤洗涤沉淀的操作: _________________________________ ___ __ 。 关小水龙头,使洗涤剂缓缓通过沉淀物 解析 洗涤 沉淀时应关小水龙头,让洗涤剂与沉淀物充分接触。 解析答案 (4) 写出第二次浸出的化学方程式: ___________________________ __ ___ 。 向 盛有滤渣 1 的反应器中加 H 2 SO 4 和 H 2 O 2 溶液,应先加 ________ 。 解析 第二 次浸出时利用 H 2 O 2 的氧化性来实现。 H 2 O 2 + CuS + H 2 SO 4 == =CuSO 4 + S + 2H 2 O 。 H 2 O 2 在酸性条件下氧化性更强,故应先加稀硫酸。 CuS + H 2 O 2 + H 2 SO 4 == =CuSO 4 + S + 2H 2 O H 2 SO 4 1 2 3 4 5 6 7 8 9 (5) 滤渣 2 的主要成分是 _______ 。 浓缩、结晶得到硫酸锌晶体的主要仪器名称是 _______ 。 解析 滤渣 1 的主要成分是 SiO 2 和 CuS ,故滤渣 2 的主要成分为 SiO 2 ,浓缩结晶所用的主要仪器为蒸发皿、酒精灯等。 解析答案 SiO 2 蒸发皿 1 2 3 4 5 6 7 8 9 (6) 某同学在实验完成之后,得到 1.50 g CuSO 4 ·5H 2 O ,则铜的回收率为 ________ 。 解析答案 30.0% 1 2 3 4 5 6 7 8 9 7 . 硫酸亚铁铵的化学式为 (NH 4 ) 2 SO 4 ·FeSO 4 ·6H 2 O ,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。三种盐的溶解度 ( 单位为 g/100 g 水 ) 如下表: 温度 / ℃ 10 20 30 40 50 70 (NH 4 ) 2 SO 4 73.0 75.4 78.0 81.0 84.5 91.9 FeSO 4 ·7H 2 O 40.0 48.0 60.0 73.3 — — (NH 4 ) 2 SO 4 · FeSO 4 ·6H 2 O 18.1 21.2 24.5 27.9 — — 1 2 3 4 5 6 7 8 9 Ⅰ . 实验室制取少量摩尔盐的流程如下: 1 2 3 4 5 6 7 8 9 试 回答下列问题: (1) 步骤 3 中进行 “ 趁热快速过滤 ” ,可采取的措施是 _______________ ____________________( 写出 1 种 ) ,趁热 过滤的目的 是 ___________________________ 。 (2) 步骤 4 中加热浓缩至 ________________ 时为止 。 (3) 步骤 4 中析出的晶体不含 (NH 4 ) 2 SO 4 、 FeSO 4 的原因是 ____________ _____________________________________________________ ,理论上制得的摩尔盐的质量为 __________ ___ _ 。 1 2 3 4 5 6 7 8 9 预热后进行快速热过滤 防止 FeSO 4 ·7H 2 O 晶体析出 将漏斗置于沸水中 液体表面出现晶膜 在相同温度下, (NH 4 ) 2 SO 4 ·FeSO 4 ·6H 2 O 的溶解度比 (NH 4 ) 2 SO 4 、 FeSO 4 都要小 7( m 1 - m 2 ) g 答案 Ⅱ . 称取两份质量均为 1.96 g 的该硫酸亚铁铵,制成溶液。用未知浓度的酸性 KMnO 4 溶液进行滴定 。 (1) 滴定时,将酸性 KMnO 4 溶液装在 ________( 填 “ 酸式 ” 或 “ 碱式 ” ) 滴定管。已知 MnO 被 还原为 Mn 2 + ,试写出该滴定过程中的离子方程式 : _________________________________________ 。 (2) 判断该反应到达滴定终点的现象 为 ____________________________ ________________________________________ ____ _____ 。 答案 酸式 当最后一滴酸性 KMnO 4 溶液滴下时,溶液变成紫色, 30 s 内不褪色,说明达到滴定终点 1 2 3 4 5 6 7 8 9 (3) 假设到达滴定终点时,用去 V mL 酸性 KMnO 4 溶液,则该酸性 KMnO 4 溶液的浓度为 ____ mol·L - 1 。 答案 1 2 3 4 5 6 7 8 9 解析 解析 以物质的制备为背景材料的实验题对实验能力的要求是很弹性的,可以问最简单的实验仪器使用、基本操作,也可以提高到实验步骤的分析能力,还可以灵活考查实验方法的灵活运用能力,甚至可以渗透实验方案设计。由于试题情景的绝对真实性,所涉及的反应原理、实验操作方法一般都是常用的、实用的,仪器也是比较常见的。所以应该把精力放在理解透基本的实验方法、实验原理上。如本题因为 FeSO 4 在低温时溶解度较小,应采用趁热过滤,如果不趁热过滤就会有 FeSO 4 ·7H 2 O 晶体析出,过滤时会出现漏斗堵塞现象。 1 2 3 4 5 6 7 8 9 题组三 基本操作与有机物的制备 解题指导 1 2 3 4 5 6 7 8 9 阿司匹林的合成流程: 1 2 3 4 5 6 7 8 9 8. 阿斯匹林 ( 乙酰水杨酸 ) 是由水杨酸和乙酸酐合成的:在生成乙酰水杨酸的同时,水杨酸分子间也能发生缩合反应,生成少量聚合物 ( 副产物 ) 。 主反应 : 副反应 : 1 2 3 4 5 6 7 8 9 合成乙酰水杨酸的实验步骤如下: ① 向 150 mL 干燥锥形瓶中加入 2 g 水杨酸、 5 mL 乙酸酐和 5 滴浓硫酸,振荡,待其溶解后,控制温度在 85 ~ 90 ℃ 条件下反应 5 ~ 10 min 。然后冷却,即有乙酰水杨酸晶体析出。 ② 减压过滤,用滤液淋洗锥形瓶,直至所有晶体被收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干 。 1 2 3 4 5 6 7 8 9 ③ 将粗产品置于 100 mL 烧杯中,搅拌并缓慢加入 25 mL 饱和碳酸氢钠溶液,加完后继续搅拌 2 ~ 3 分钟,直到没有二氧化碳气体产生为止。过滤,用 5 ~ 10 mL 蒸馏水洗涤沉淀,合并滤液于烧杯中,不断搅拌,慢慢加入 15 mL 4 mol·L - 1 盐酸,将烧杯置于冷水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体 1 ~ 2 次,再抽干水分,即得产品 。 请思考回答下列问题: (1) 第 ① 步中,要控制反应温度在 85 ~ 90 ℃ ,应采用 ________ 加热方法。用这种加热方法需要的玻璃仪器 有 _____________________ 。 水浴 答案 酒精灯、烧杯、温度计 1 2 3 4 5 6 7 8 9 (2) 在第 ② 步中,用冷水洗涤晶体,其目的是 _______________________ ____________________________ __ __ 。 (3) 第 ③ 步中,加入碳酸氢钠的作用是 _________________________ ________________________ , 加入盐酸的作用是 _________________ ___________________________________________ 。 (4) 如何检验产品中是否混有水杨酸 _____________________________ ___________________________________________________________________________________ 。 答案 洗涤晶体表面附着的杂质、减少阿斯匹林因溶解而引起的损耗 使阿斯匹林转化为可溶性盐, 而与不溶性的物质相互分离 将阿斯匹林的可溶性盐重新转化为阿斯匹林,从而达到提纯的目的 向水中加入少量产品,然后滴加 FeCl3 溶液,若有紫色出现,说明产品中有水杨酸;若无紫色出现,说明产品中不含水杨酸 1 2 3 4 5 6 7 8 9 9 . 苯甲酸 是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下: C 6 H 5 —CH 3 + 2KMnO 4 C 6 H 5 —COOK + KOH + 2MnO 2 ↓ + H 2 O C 6 H 5 —COOK + HCl ―― → C 6 H 5 —COOH + KCl 已知甲苯的熔点为- 95 ℃ ,沸点为 110.6 ℃ ,易挥发,密度为 0.866 g·cm - 3 ;苯甲酸的熔点为 122.4 ℃ ,在 25 ℃ 和 95 ℃ 下溶解度分别为 0.3 g 和 6.9 g 。 1 2 3 4 5 6 7 8 9 【制备产品】 30.0 mL 甲苯和 25.0 mL 1 mol·L - 1 高锰酸钾溶液在 80 ℃ 下反应 30 min ,装置如图所示: (1) 图中恒压滴液漏斗支管的作用是 _______ ______________________________ 。 (2) 在本实验中,三颈烧瓶最合适的容积是 ____ ( 填字母 ) 。 A.50 mL B.100 mL C.200 mL D.250 mL 平衡 压强,使甲苯顺利滴入三颈烧瓶 B 答案 1 2 3 4 5 6 7 8 9 【分离产品】他们设计如下流程分离粗产品苯甲酸和回收甲苯: 1 2 3 4 5 6 7 8 9 (3) 操作 Ⅰ 的名称是 ________ ;含杂质的产物经操作 Ⅱ 进一步提纯得无色液体 A ,则操作 Ⅱ 的名称是 _____ 。 (4) 操作 Ⅲ 的名称是 _______ ___ _ 。检验 B 中是否含有 Cl - 的方法如下:取少量 B 溶于水,在上层清液中滴加稀硝酸酸化的 ________ 溶液,若产生白色沉淀,则 B 中含有 Cl - 。 答案 分液 蒸馏 冷却、过滤 AgNO 3 归纳总结 返回 1 2 3 4 5 6 7 8 9 有机物制备实验中易错点 (1) 温度计水银球的位置:若要控制反应温度,应插入反应液中,若要选择收集某温度下的馏分,则应放在支管口附近。 (2) 冷凝管的选择:球形冷凝管只能用于冷凝回流,直形冷凝管既能用于冷凝回流,也能用于冷凝收集馏分。 (3) 冷凝管的进出水方向: “ 下进上出 ” 。 (4) 加热方法的选择 ① 酒精灯加热。酒精灯的火焰温度一般在 400 ~ 500 ℃ ,所以需要温度不太高的实验都可用酒精灯加热 。 归纳总结 归纳总结 1 2 3 4 5 6 7 8 9 ② 水浴加热。水浴加热的温度不超过 100 ℃ 。 (5) 防暴沸:加碎瓷片,防止溶液暴沸,若开始忘加沸石,需冷却后补加 。 返回 1 2 3 4 5 6 7 8 9 考点二 物质 的检验及组成的定量测定 1 . 定量测定数据测定的常用方法 (1) 沉淀法 先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。 (2) 测气体体积法 对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度 。 量 气装置的设计: 下列 装置中, A 是常规的量气装置, B 、 C 、 D 是改进后的量气装置。 (3) 测气体质量法 将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算 。 ( 4) 滴定法 即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原反应滴定等获得相应数据后再进行相关计算 。 (5) 热重法 只要物质受热时发生质量变化,都可以用热重法来研究物质的组成在控制温度的条件下,测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息 。 2. 应用举例 碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。 (1) 采用装置 A ,在高温下将 x 克钢样中碳、硫转化为 CO 2 、 SO 2 。 ① 气体 a 的成分是 ________________ 。 解析 钢 样中的碳、硫在装置 A 中高温加热条件下生成 CO 2 和 SO 2 ,还有未反应的 O 2 ,故气体 a 的成分为 O 2 、 SO 2 、 CO 2 。 O 2 、 SO 2 、 CO 2 解析答案 解析答案 Fe 3 O 4 SO 2 解析答案 (2) 将气体 a 通入测硫装置中 ( 如下图 ) ,采用滴定法测定硫的含量。 ① H 2 O 2 氧化 SO 2 的化学方程式: ____________________ 。 解析 H 2 O 2 和 SO 2 发生氧化还原反应: H 2 O 2 + SO 2 == =H 2 SO 4 。 H 2 O 2 + SO 2 == =H 2 SO 4 解析答案 ② 用 NaOH 溶液滴定生成的 H 2 SO 4 ,消耗 mL NaOH 溶液,若消耗 1 mL NaOH 溶液相当于硫的质量为 y 克,则该钢样中硫的质量分数: __________________ 。 解析答案 (3) 将气体 a 通入测碳装置中 ( 如下图 ) ,采用重量法测定碳的含量。 ① 气体 a 通过 B 和 C 的目的是 _________________________ 。 解析 气体 a 中含有 O 2 、 SO 2 和 CO 2 ,在吸收 CO 2 测定碳的含量时,也可能吸收 SO 2 ,故气体 a 通过装置 B 和 C 的目的排除 SO 2 对 CO 2 测定的干扰 。 排除 SO 2 对 CO 2 测定的干扰 解析答案 ② 计算钢样中碳的质量分数,应测量的数据是 _____________ ___________ ___ 。 解析 计算 钢样中碳的质量分数,应测量吸收 CO 2 前、后吸收瓶的质量,其质量差为 CO 2 的质量。 吸收 CO 2 前、 后吸收瓶的质量 1 2 3 题组集训 1 4 5 6 7 8 题组一 物质成分的检验与常见物质的鉴别 1 . 检验 牙膏中是否含有甘油选用的试剂是 ( ) A. 氢氧化钠溶液 B . 氢氧化铜浊液 C. 醋酸溶液 D . 碳酸钠溶液 9 10 2 . 用于 检验火柴头燃烧可产生 SO 2 的装置正确的是 ( ) 1 2 3 4 5 6 7 8 9 10 4 . 亚硝酸 钠又称为 “ 工业盐 ” ,在新闻报道中常出现因误食工业盐而导致中毒的事件。下列关于亚硝酸钠的叙述不正确的是 ( ) A. 亚硝酸钠外观与食盐相似 B. 亚硝酸钠和食盐一样也具有咸味 C. 食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂 D. 亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀 1 2 3 4 5 6 7 8 9 10 5 . 下列 各组仅用蒸馏水不能鉴别的是 ( ) A. 苯、酒精、硝基苯 B. 食盐、烧碱、硝酸铵 C. 蔗糖、硫酸铜粉末、碳酸钙粉末 D. 氧化铜、二氧化锰、活性炭 1 2 3 4 5 6 7 8 9 10 6 . 下列 用水能鉴别的一组物质是 ( ) A. 乙酸乙酯、甘油、硝基苯 B. 乙醇、甘油、四氯化碳 C. 乙酸乙酯、苯、乙醇 D. 苯、四氯化碳、硝基苯 解析 1 2 3 4 5 6 7 8 9 10 解析 A 项,乙酸乙酯不溶于水,且密度小于水,浮在水面,出现分层,甘油溶于水,不出现分层,硝基苯为不溶于水的液体,且密度大于水,在水的下层,可以鉴别,正确 ; B 项,乙醇、甘油都溶于水,不出现分层,无法区分,错误 ; C 项,乙酸乙酯、苯都不溶于水,且密度都小于水,因此无法鉴别,错误 ; D 项,四氯化碳、硝基苯为均不溶于水的液体,且密度大于水,都出现分层,且都在水的下层,因此无法鉴别,错误 。 1 2 3 4 5 6 7 8 9 10 7 . 下列 方法中不能用来区别 NaNO 2 和 NaCl 的是 ( ) A. 测定这两种溶液的 pH 值 B. 在酸性条件下加入 KI 淀粉溶液 C. 观察二者的颜色 D. 用 AgNO 3 和 HNO 3 两种试剂来区别 解析 1 2 3 4 5 6 7 8 9 10 解析 A 项,测定 pH 时, pH 大的为 NaNO 2 ,可鉴别,不符合题意 ; B 项,溶液变蓝的为 NaNO 2 ,无现象的为 NaCl ,可鉴别,不符合题意 ; C 项,均为无色溶液,观察不能鉴别,符合题意 ; D 项,生成白色沉淀的为 NaCl ,无现象的为 NaNO 2 ,可鉴别,不符合题意。 1 2 3 4 5 6 7 8 9 10 8 . 物质 的鉴别有多种方法。下列能达到鉴别目的的是 ( ) ① 用水鉴别苯、乙醇、溴苯 ② 用相互滴加的方法鉴别 Ca (OH) 2 和 NaHCO 3 溶液 ③ 点燃鉴别甲烷和乙炔 A. ①② B . ①③ C. ②③ D . ①②③ 解析 1 2 3 4 5 6 7 8 9 10 解析 苯、溴苯不溶于水,当二者分别与水混合时,苯在上层,溴苯在下层,乙醇和水互溶, ① 能达到鉴别目的 。 Ca (OH) 2 和 NaHCO 3 相互滴加的反应方程式虽然不同,但现象都是生成白色沉淀,所以 ② 达不到鉴别目的 。 甲烷 燃烧产生淡蓝色火焰,乙炔燃烧产生明亮的火焰,并且伴有浓烟 , ③ 能达到鉴别目的,答案选 B 。 1 2 3 4 5 6 7 8 9 10 题组二 物质制备与定量测定 9. 铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁 3% ~ 5% 的铝镁合金 ( 不含其他元素 ) 中镁的质量分数,设计了下列两种不同实验方案进行探究。 [ 方案一 ] [ 实验方案 ] 将铝镁合金与足量 NaOH 溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 ____________________________________ 。 解析 方案一:将铝镁合金与足量 NaOH 溶液反应,镁不和 NaOH 溶液反应,铝发生反应: 2Al + 2NaOH + 2H 2 O == =2NaAlO 2 + 3H 2 ↑ 。 2Al + 2NaOH + 2H 2 O == =2NaAlO 2 + 3H 2 ↑ 解析答案 1 2 3 4 5 6 7 8 9 10 [ 实验步骤 ] (1) 称取 10.8 g 铝镁合金粉末样品,溶于体积为 V 、物质的量浓度为 4.0 mol·L - 1 的 NaOH 溶液中,充分反应。则 NaOH 溶液的体积 V ≥ ____ mL 。 解析 假设 合金中镁的质量分数最少为 3% ,则 10.8 g 铝镁合金粉末样品中含有铝 10.476 g ,其物质的量是 0.388 mol ,根据反应 2Al + 2NaOH + 2H 2 O == =2NaAlO 2 + 3H 2 ↑ 知,需要 n ( NaOH ) = n (Al) = 0.388 mol , V ( NaOH ) = 0.388 mol /4.0 mol·L - 1 = 0.097 L 。 97 解析答案 1 2 3 4 5 6 7 8 9 10 ( 2) 过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 _______( 填 “ 偏高 ” 、 “ 偏低 ” 或 “ 无影响 ” ) 。 解析 过滤后,金属镁的表面会沾有其他离子,如果没有洗涤,称量后的固体的质量将大于镁的实际质量,所测得镁的质量分数将偏高。 偏高 解析答案 1 2 3 4 5 6 7 8 9 10 [ 方案二 ] [ 实验方案 ] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。 [ 实验步骤 ] (1) 同学们拟选用下列实验装置完成实验: 你认为最简易的装置其连接顺序是 A 接 ( )( ) 接 ( G )( ) 接 ( )( 填接口字母,可不填满 ) 。 解析 答案 E D 1 2 3 4 5 6 7 8 9 10 解析 很明显,该同学采用排水法来测量产生氢气的体积,故 A 应连接 E , D 连接 G 。 ( 最后读数时要调节广口瓶和量筒中的液面高度, F 接口的导管太短 ) 。 1 2 3 4 5 6 7 8 9 10 (2) 仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。 1 2 3 4 5 6 7 8 9 10 ① 装置中导管 a 的作用是 _________________________________________ ___________________________________________________________________________________________________________________________________________ ; 解析 用导管 a 连接后,滴入锥形瓶的稀硫酸的体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差; 使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸的体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的体积误差 解析答案 1 2 3 4 5 6 7 8 9 10 ② 实验前后量气管中液面读数分别为 V 1 mL 、 V 2 mL ,则产生氢气的体积为 __________mL ; 解析 量气管的 0 刻度在上,故产生氢气的体积为 ( V 1 - V 2 ) mL ; ( V 1 - V 2 ) ③ 若需确定产生氢气的量,还需测定的数据是 ____________________ 。 解析 若需确定产生氢气的量,还需知道实验时的温度和压强。 解析答案 实验时的温度和压强 1 2 3 4 5 6 7 8 9 10 10.Na 2 S 2 O 3 俗称大苏打 ( 海波 ) 是重要的化工原料。用 Na 2 SO 3 和硫粉在水溶液中加热反应,可以制得 Na 2 S 2 O 3 。已知 10 ℃ 和 70 ℃ 时, Na 2 S 2 O 3 在 100 g 水中的溶解度分别为 60.0 g 和 212 g 。常温下,从溶液中析出的晶体是 Na 2 S 2 O 3 ·5H 2 O 。 现实验室欲制取 Na 2 S 2 O 3 ·5H 2 O 晶体 (Na 2 S 2 O 3 ·5H 2 O 的分子量为 248) 步骤如下: ① 称取 12.6 g Na 2 SO 3 于烧杯中,溶于 80.0 mL 水。 ② 另取 4.0 g 硫粉,用少许乙醇润湿后,加到上述溶液中。 1 2 3 4 5 6 7 8 9 10 ③ ( 如图所示,部分装置略去 ) ,水浴加热,微沸,反应约 1 小时后过滤。 ④ 滤液在经过加热浓缩、冷却结晶后析出 Na 2 S 2 O 3 ·5H 2 O 晶体。 ⑤ 进行减压过滤并干燥。 1 2 3 4 5 6 7 8 9 10 (1) 仪器 B 的名称是 ___________ 。加入的硫粉用乙醇润湿的目的是 __________________________________ 。 解析答案 解析 根据装置图可知,仪器 B 为球形冷凝管,使烧瓶中的液体进行冷凝回流,硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,有利于硫粉和 Na 2 SO 3 溶液充分接触,加快反应速率。 球形冷凝管 增加反应物接触面积,提高反应速率 1 2 3 4 5 6 7 8 9 10 (2) 滤液中除 Na 2 S 2 O 3 和可能未反应完全的 Na 2 SO 3 外,最可能存在的无机杂质是 _________ 。 解析答案 Na 2 SO 4 1 2 3 4 5 6 7 8 9 10 滴定次数 滴定前读数 (mL) 滴定后读数 (mL) 第一次 0.30 31.12 第二次 0.36 31.56 第三次 1.10 31.88 则所得产品的纯度为 ________ ,你认为影响纯度的主要原因是 ( 不考虑操作引起的误差 )_____________________________________________ 。 淀粉溶液 酸式 103.2% 含有的 Na 2 SO 3 也会和 I 2 发生反应,从而影响纯度 解析 答案 返回 1 2 3 4 5 6 7 8 9 10 解析 1 2 3 4 5 6 7 8 9 10 解得 x = 0.003 08 mol ,故 Na 2 S 2 O 3 ·5H 2 O 的物质的量为 0.003 08 mol ,质量: 0.003 08×248 g·mol - 1 = 0.763 8 g , 碘单质有强的氧化性, Na 2 SO 3 具有还原性, Na 2 SO 3 会和 I 2 发生反应,从而影响纯度。 返回 1 2 3 4 5 6 7 8 9 10查看更多