化学卷·2019届湖南省益阳市箴言中学高二上学期期中考试(2017
2017年下学期期中考试高二化学(理科类)
时量:90分钟 分值:100分
可能用到的相对原子质量: H 1 C 12 O 16
第一部分 选择题(共54分)
一、单项选择题(本题共18小题,每小题3分,共54分。)
1、下列物质的电子式正确的是 ( )
2、在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
3、下列物质的沸点按由高到低的顺序排列正确的是( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
4、核磁共振氢谱是测定有机分子结构最有用的工具之一。在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同。根据峰值(信号)可以确定有机物中氢原子的种类。下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是( )
A.CH30H B.CH3COCH3 C.CH3COOH D.CH3COOCH3
5、已在H—H键的键能为436 kJ·mol-1,H—N键的键能为391 kJ·mol-1,根据热化学方程式N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1,推求N≡N键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1 C.649 kJ·mol-1 D.1130 kJ·mol-1
6、在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是 ( )
A.v(SO2)=4 mol·L-1·min-1 B.v(SO2)=0.1 mol·L-1·s-1
C.v(O2)=3 mol·L-1·min-1 D.v(O2)=0.1 mol·L-1·s-1
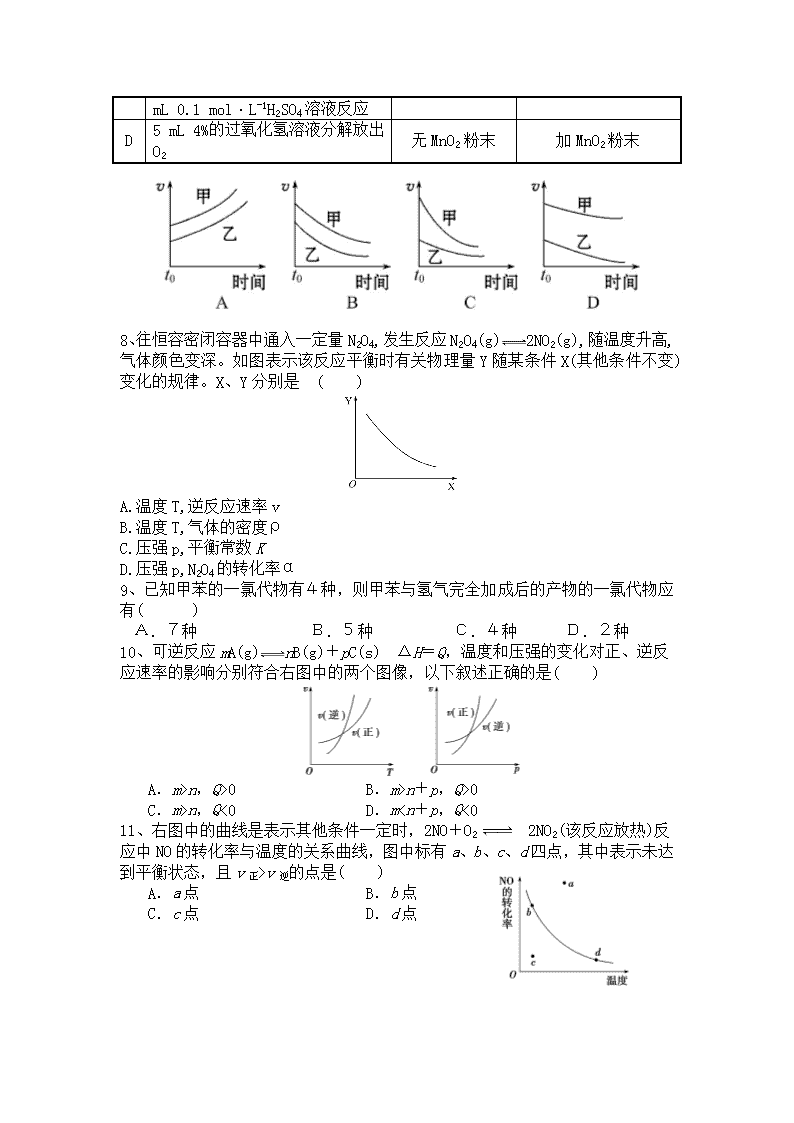
7、下列表格中的各种情况,可以用下面对应选项中的图象曲线表示的是 ( )
反应
甲
乙
A
外形、大小相近的金属和水反应
Na
K
B
4 mL 0.01 mol·L-1的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液2 mL反应
0.1 mol·L-1的H2C2O4溶液
0.2 mol·L-1的H2C2O4溶液
C
5 mL 0.1 mol·L-1Na2S2O3溶液和5
热水
冷水
mL 0.1 mol·L-1H2SO4溶液反应
D
5 mL 4%的过氧化氢溶液分解放出O2
无MnO2粉末
加MnO2粉末
8、往恒容密闭容器中通入一定量N2O4,发生反应N2O4(g)2NO2(g),随温度升高,气体颜色变深。如图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律。X、Y分别是 ( )
A.温度T,逆反应速率v
B.温度T,气体的密度ρ
C.压强p,平衡常数K
D.压强p,N2O4的转化率α
9、已知甲苯的一氯代物有4种,则甲苯与氢气完全加成后的产物的一氯代物应有( )
A.7种 B.5种 C.4种 D.2种
10、可逆反应mA(g)nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是( )
A.m>n,Q>0 B.m>n+p,Q>0
C.m>n,Q<0 D.m
v逆的点是( )
A.a点 B.b点
C.c点 D.d点
12、乙醇的燃烧热为ΔH1,甲醇的燃烧热为ΔH2,且ΔH1<ΔH2,若乙醇和甲醇的混合物1 mol完全燃烧,反应热为ΔH3,则乙醇和甲醇的物质的量之比为( )
A. B.
C. D.
13、已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
A.84% B.60% C.91% D.42%
14、反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。下列有关叙述正确的是( )
A.E2表示反应X―→C的活化能
B.X是反应A+B―→C的催化剂
C.反应A+B―→C的ΔH<0
D.加入催化剂可改变反应A+B―→C的焓变
15、某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
16、将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是 ( )
A.2v(NH3)=v(CO2) B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
17、某烃的组成中含碳、氢元素的质量比为6:1,该烃对氮气的相对密度为2,该烃能与H2发生加成反应,所得加氢产物的二氯代物有三种同分异构体,则该烃为( )
A.CH2=CH﹣CH2﹣CH3 B.CH2=CH2
C.CH3﹣CH=CH﹣CH3 D.
18、下列实验可达到实验目的是( )
①将与NaOH的醇溶液共热制备CH3﹣CH═CH2
②与适量NaHCO3溶液反应制备
③向CH3CH2Br中滴入AgNO3溶液以检验溴元素
④用溴水即可检验CH2=CH﹣CHO中的碳碳双键.
A.只有①③④ B.只有①④ C.只有① D.都不能
第二部分 非选择题(共46分)
二、非选择题(本题共4个题目。每空2分,共46分)
19、(10分)参考下列图表和有关要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:_____________________________________。
(3)下表是部分化学键的键能数据:
化学键
P—P
P—O
O===O
P===O
键能(kJ·mol-1)
a
b
c
x
已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1(用含有a、b、c、d的代数式表示)。
20、 (14分)已知化学反应①:Fe(s)+CO2(g)FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)FeO(s)+H2(g),其化学平衡常数为K2,在温度
973 K和1 173 K的情况下,K1、K2的值分别如下:
温度
K1
K2
973 K
1.47
2.38
1 173 K
2.15
1.67
请填空:
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有__________
(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是______________________________。
②图乙中t2时刻发生改变的条件是______________________________。
21、(10分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:_______________________________________________________________________________
(2)甲和乙两个水浴作用不相同。甲的作用是__________;乙的作用是__________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入__________(填写字母)。然后,再通过蒸馏即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
22、(12分)已知:
烃基烯基醚A的相对分子质量(Mr)为l76,分子中碳氢原子数目比为3:4,与A相关的反应如下:
请回答下列问题:
(1)A的分子式为 .
(2)B的结构简式是 ;A的结构简式为 .
(3)写出C→D反应的化学方程式:
(4)写出两种同时符合下列条件的E的同分异构体的结构简式
①属于芳香烃;②苯环上有两种不同环境的氢原子.
E的同分异构体为: 或者
2017年箴言中学期中考试——高二化学(理科类)答案
第一部分 选择题(共54分)
一、单项选择题(本题共18小题,每小题3分,共54分。)
1. D 2. B 3. A 4. B 5. B
6. D 7. C 8. D 9. B 10. C
11. C 12. B 13. A 14.C 15. B
16. C 17. D 18. D
第二部分 非选择题(共46分)
二、非选择题(本题每空2分,总共46分)
19、(共10分)
(1)减小 ; 不变 ; NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(2)CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l)ΔH=-764.7 kJ·mol-1
(3)
20、(共14分)
(1)吸热 (2)
(3)K3=K1× 吸热 (4)C、E
(5)①增大压强或使用催化剂 ②降低温度或从体系中分离出H2
21、(共10分) 2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+Cu+H2O ;加热 ; 冷却; 乙酸; c
22、(共12分)
(1)C12H16O (2)CH3CH2CH2OH (3)
(4)CH3CH2CHO+2Ag(NH3)2OHCH3CH2COONH4+2Ag↓+3NH3+H2O .
(5) ; (合理答案都可以)