- 2021-06-04 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省沈阳市第一七O中学2019-2020年高一上学期期中考试化学试卷
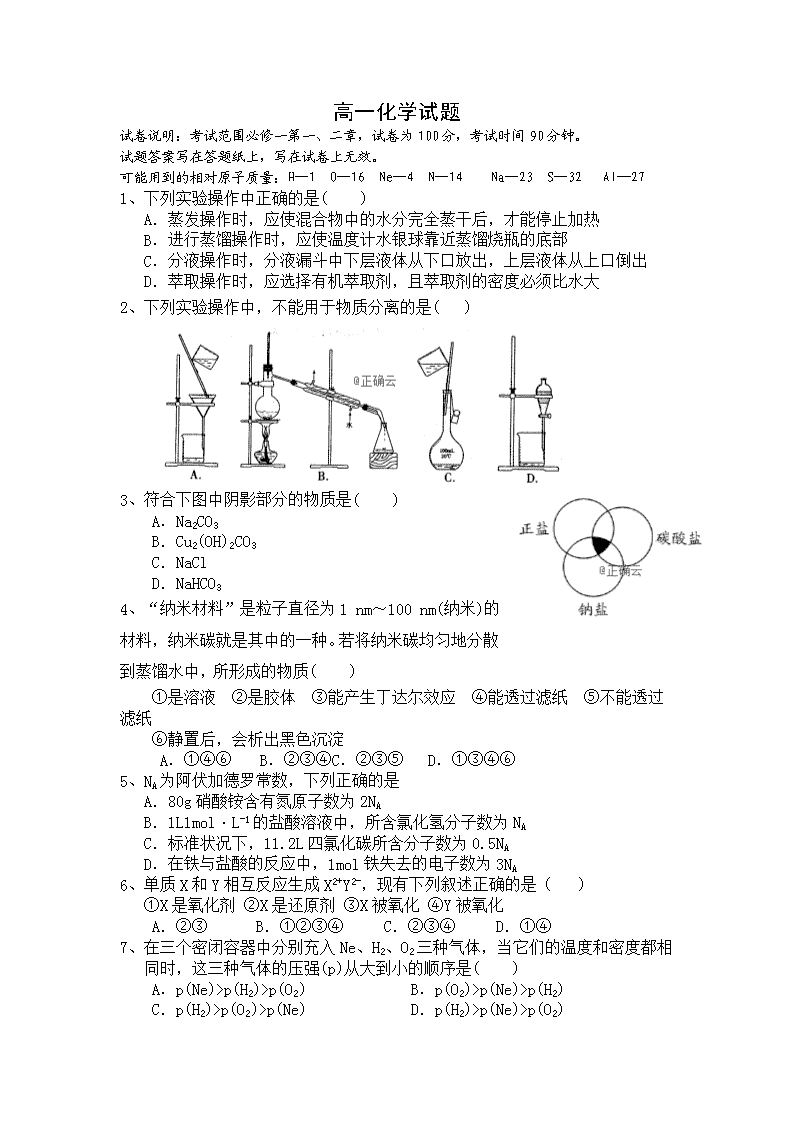
高一化学试题 试卷说明:考试范围必修一第一、二章,试卷为100分,考试时间90分钟。 试题答案写在答题纸上,写在试卷上无效。 可能用到的相对原子质量:H—1 O—16 Ne—4 N—14 Na—23 S—32 Al--27 1、下列实验操作中正确的是( ) A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 B.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 2、下列实验操作中,不能用于物质分离的是( ) 3、符合下图中阴影部分的物质是( ) A.Na2CO3 B.Cu2(OH)2CO3 C.NaCl D.NaHCO3 4、“纳米材料”是粒子直径为1 nm~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( ) ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀 A.①④⑥ B.②③④C.②③⑤ D.①③④⑥ 5、NA为阿伏加德罗常数,下列正确的是 A.80g硝酸铵含有氮原子数为2NA B.1L1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA C.标准状况下,11.2L四氯化碳所含分子数为0.5NA D.在铁与盐酸的反应中,1mol铁失去的电子数为3NA 6、单质X和Y相互反应生成X2+Y2-,现有下列叙述正确的是( ) ①X是氧化剂 ②X是还原剂 ③X被氧化 ④Y被氧化 A.②③ B.①②③④ C.②③④ D.①④ 7、在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( ) A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2) C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2) 8、下列溶液中含Cl-物质的量浓度最大的是( ) A.10 mL 0.1 mol/L的AlCl3溶液B.20 mL 0.1 mol/L CaCl2溶液 C.30 mL 0.2 mol/L的KCl溶液 D.40 mL 0.5 mol/L的NaClO3溶液 9、下列离子方程式书写正确的是( ) A.向NaOH溶液中通入少量CO2:CO2+OH-===HCO3- B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O C.盐酸滴入氨水中:H++OH-===H2O D.碳酸钙溶解于稀硝酸中:CO32-+2H+===CO2↑+H2O 10、根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序 I2+SO2+2H2O=H2SO4+2HI 2FeCl2+Cl2=2FeCl3 2FeCl3+2HI=2FeCl2+2HCl+I2 (A)I->Fe2+>Cl->SO2 (B)Cl->Fe2+>SO2>I- (C)Fe2+>I->Cl->SO2 (D)SO2>I->Fe2+>Cl- 11、在某无色透明的酸性溶液中,能大量共存的离子组是( ) A.Na+、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3- C.Na+、K+、Cl-、NO3 D.Fe2+、K+、SO42-、Cl- 12、在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是( ) A.Fe B.Cl C.Br D.Fe和Br 13、被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,NaBH4+2H2O===NaBO2+4H2↑,下列有关该反应的说法中,正确的是( ) A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂 C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1∶1 14、某盐的混合物中含有0.2mol/L K+、0.4mol/L Mg2+、0.4mol/L Cl-,则SO42-为( ) A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L 15、有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为 A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a 16、在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为( ) A . B. C. D.1000VρM(MV+2240) 第Ⅱ卷 17、(7x2分=14分)以下12种物质为中学化学中常见的物质: ①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩Fe(OH)3 ⑪NaOH ⑫NH3·H2O 请按下列分类标准回答问题。 (1)属于电解质的是__________ ,属于非电解质 , (2)能电离出H+的是__________ ,属于酸的是_______ ___ 。 (3)属于碱的是_____,其中属于难溶性碱的是_______,(4)属于难溶盐的是________。 18、(13x1分=13分)欲用98%的浓硫酸(ρ=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml(1)选用的主要仪器有: ①量筒 ②烧杯 ③玻璃棒 ④____________, ⑤____________。 (2)请将下列各操作,按正确的序号填在横线上。(每个步骤只用一次) A.用量筒量取浓H2SO4,B.反复颠倒摇匀 C.用胶头滴管加蒸馏水至刻度线 D.洗净玻璃棒和烧杯 E.稀释浓H2SO4 F.将溶液转入容量瓶 其操作正确的顺序依次为____________________________。 (3)简要回答下列问题: ①所需浓硫酸的体积为__________mL。 ②如果实验室有15mL、20mL、50mL的量筒应选用_________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度_____(“偏高”、“偏低”、“无影响”下同) ③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度____________。 ④在转入容量瓶前烧杯中液体应____________,否则会使浓度____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。 ⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度_______;仰视则使浓度___。 19、(7x1=7分)某河道两旁有甲、乙两厂,它们排放的工业废水中,共含有K+、Ag+、 Fe3+、Cl-、OH-、NO3-六种离子。 (1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____ 、_____ 、_______ 。 (2)乙厂的废水中含有另外三种离子。如果加一定量__________ (填“活性炭”或“铁粉”)可以回收其中的__________ (填写金属元素符号)。 (3)另一种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的__________ (填写离子符号)转化为沉淀,经过滤后的废水主要离子__________ ,可用来浇灌农田。 △ 20、(共18分)(1)煤是我国最主要的能源之一,在一次能源消费量中占75%。但是煤直接燃烧产生的SO2是引起酸雨的主要原因。在煤的燃烧过程中,95%以上的硫转化成SO2。工业上用石灰石脱硫,其相关的化学反应方程式为: 反应Ⅰ: CaCO3 ===== CaO + CO2↑ 反应Ⅱ:2CaO + 2SO2 + O2 ==== 2CaSO4 ①上述反应Ⅰ属于 a.氧化还原反应 b.分解反应 c.非氧化还原反应 d.化合反应 ②反应Ⅱ中O2是 a.氧化剂 b.还原剂 c.既是氧化剂又是还原剂 d.既不是氧化剂又不是还原剂 ③用“单线桥法”表示反应Ⅱ中电子的转移方向和数目: 2CaO + 2SO2 + O2 ==== 2CaSO4 (2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为: 10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。 请回答下列问题: ①上述反应中,__________ 元素的化合价升高,则该元素的原子__________ (填“得到”或“失去”)电子;而__________ 元素的化合价降低,则该元素的原子被__________ (填“氧化”或“还原”)。 ②用“双线桥法”表示反应中电子转移的方向和数目: 10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O ③上述反应中氧化剂和还原剂物质的量之比 ;当有10mol电子转移时有 克Al消耗,生成标况下的气体体积 L。 化学答案纸 第Ⅰ卷(48分) 选择题答案(16 x 3分=48分) 1 2 3 4 5 6 7 8 C C A B A A D A 9 10 11 12 13 14 15 16 B D C D D C D B 第 Ⅱ 卷 17、(7x2分=14分) (1)属于电解质的是②③⑤⑦⑧⑨⑩⑪⑫,属于非电解质 ④⑥ (2)能电离出H+的是__③⑤______ ,属于酸的是___③___ ___ 。 (3)属于碱的是____⑨⑩⑪⑫______ ,其中属于难溶性碱的是____⑨⑩______ 。 (4)属于难溶盐的是_____⑦⑧__ ___ 18、(13 x 1分 = 13分) ④___500ml容量瓶_________,⑤____胶头滴管________。 (2)其操作正确的顺序依次为___A E F D C B ____________。 (3)①___13.6_______mL。 ②___15______mL浓度___偏低 __(“偏高”、“偏低”、“无影响”下同) ③、不断搅拌的目的是______及时散热______,若搅拌过程中有液体溅出结果会使浓度___偏低_________。 ④____冷却至室温________,否则会使浓度____偏高________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____偏低________。 ⑤、_____ 偏高 __ ;、__ 偏低 _。 19、(7x1=7分) (1) ___ OH-__ 、__ Cl- ___ 、__ K+ _____ 。 (2) ___铁粉_______ _____ Ag_____(3) _____ K+_____ __ NO3-________。 20、(共18分) ① b、c ② a (每空2分) 4e- ③ 2CaO + 2SO2 + O2 ==== 2CaSO4、………………………. 。。。。。。。。。。…………….(.2分) (2) ①_____ Al ___ ,___失去_______; ___ N _______ _____还原_____(每空1分) ② ………….(.2分) ③ 3:5 ; 90g 22.4 L(每空2分)查看更多