- 2021-06-04 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西省龙胜中学2018-2019学年高二上学期11月段考化学(文)试卷+Word版缺答案
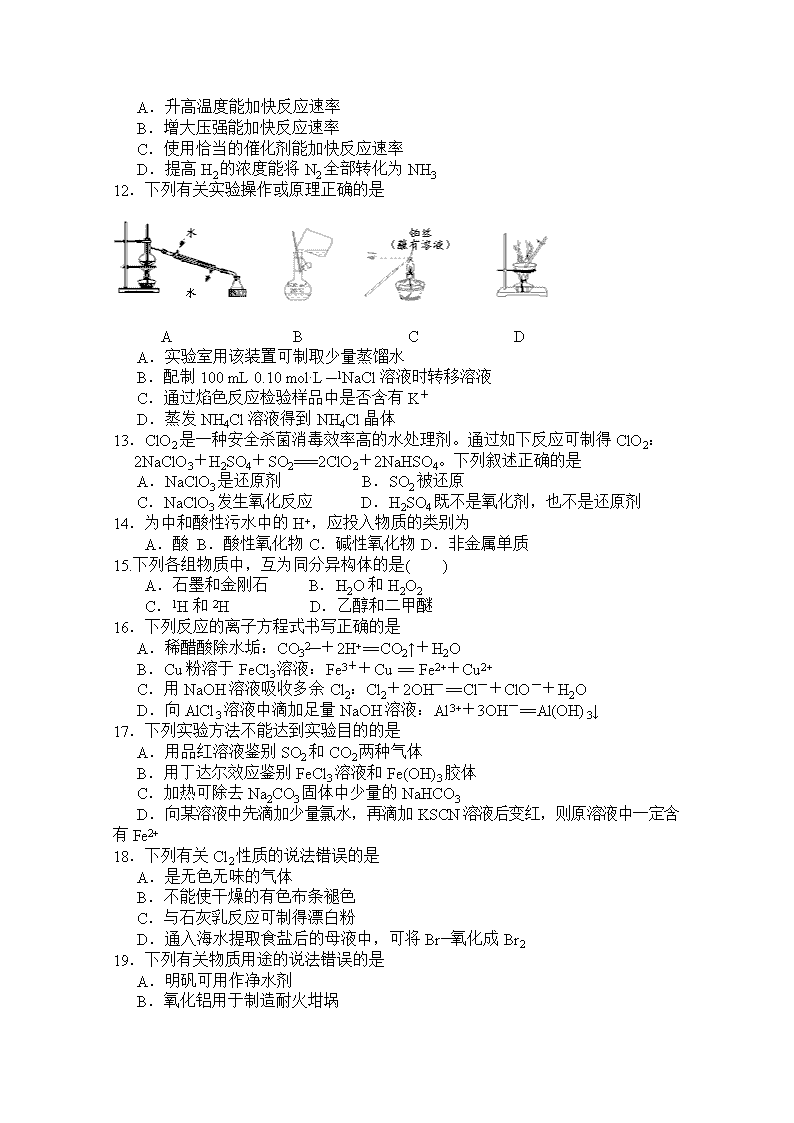
2018年秋季学期高二化学(文科)段考试卷 出卷人:陈永莉 本卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Na:23 Ca:40 Fe:56 Cu:64 第Ⅰ卷(选择题) 一、 单项选择题:在每题的4个选项中,只有1个选项是符合要求(本部分共23小题,每小题3分,共69分)。 1.太阳能电池为神舟十一号进入轨道后的运行提供了电能。制造太阳能电池板的半导体材料可以是 A.碳 B.铝合金 C.硅 D.钛合金 166 67 Ho 2.放射性同位素钬 可用于治疗肝癌。该原子的中子数是 A.67 B.99 C.166 D.233 3.下列过程主要属于化学变化的是 A.铜器锈蚀 B.碘的升华 C.氨气液化 D.石油分馏 F Cl H H O O 4.春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质(结构简式如右下图)在化学人的朋友圈中火了起来。该物质属于 A.单质 B.无机物 C.有机物 D.氧化物 ‥ H H∶N∶H 5.下列化学用语表示正确的是 A.乙酸的结构简式:C2H4O2 B.氨气的电子式: 8 2 +10 2 C. Mg2+的结构示意图: D.碳酸钠的电离方程式:Na2CO3=2Na+ + CO32— 6.下列物质属于共价化合物的是 A.CO2 B.NaCl C.N2 D.NH4Cl 7.化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是 A.纯碱—NaOH B.小苏打——NaHCO3 C.绿矾—CuSO4·5H2O D.葡萄糖—C12H22O11 8.在含有大量的Ba2+、OH—、NO3—的溶液中,还可能大量共存的离子是 A.SO42— B.HCO3— C.Cl— D.NH 9.下列属于吸热反应是 A.金属钠与水的反应 B.盐酸与氢氧化钠的反应 C.铝与氧化铁的铝热反应 D.NH4Cl晶体与Ba(OH)2·8H2O晶体反应 10.工业上可用金属钠和四氯化钛反应制备金属钛,其化学方程式为: 700~800℃ 4Na+TiCl4 4NaCl+Ti。该反应属于 A.置换反应 B.复分解反应 C.分解反应 D.化合反应 催化剂 高温、高压 11.下列关于N2+3 H2 2 NH3的反应说法错误的是 A.升高温度能加快反应速率 B.增大压强能加快反应速率 C.使用恰当的催化剂能加快反应速率 D.提高H2的浓度能将N2全部转化为NH3 12.下列有关实验操作或原理正确的是 水 A B C D A.实验室用该装置可制取少量蒸馏水 B.配制100 mL 0.10 mol·L—1NaCl溶液时转移溶液 C.通过焰色反应检验样品中是否含有K+ D.蒸发NH4Cl溶液得到NH4Cl晶体 13.ClO2是一种安全杀菌消毒效率高的水处理剂。通过如下反应可制得ClO2: 2NaClO3+H2SO4+SO2===2ClO2+2NaHSO4。下列叙述正确的是 A.NaClO3是还原剂 B.SO2被还原 C.NaClO3发生氧化反应 D.H2SO4既不是氧化剂,也不是还原剂 14.为中和酸性污水中的H+,应投入物质的类别为 A.酸 B.酸性氧化物 C.碱性氧化物 D.非金属单质 15.下列各组物质中,互为同分异构体的是( ) A.石墨和金刚石 B.H2O和H2O2 C.1H和2H D.乙醇和二甲醚 16.下列反应的离子方程式书写正确的是 A.稀醋酸除水垢:CO32—+2H+=CO2↑+H2O B.Cu粉溶于FeCl3溶液:Fe3++Cu = Fe2++Cu2+ C.用NaOH溶液吸收多余Cl2:Cl2+2OH-=Cl-+ClO-+H2O D.向AlCl3溶液中滴加足量NaOH溶液:Al3++3OH-=Al(OH)3↓ 17.下列实验方法不能达到实验目的的是 A.用品红溶液鉴别SO2和CO2两种气体 B.用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 C.加热可除去Na2CO3固体中少量的NaHCO3 D.向某溶液中先滴加少量氯水,再滴加KSCN溶液后变红,则原溶液中一定含有Fe2+ 18.下列有关Cl2性质的说法错误的是 A.是无色无味的气体 B.不能使干燥的有色布条褪色 C.与石灰乳反应可制得漂白粉 D.通入海水提取食盐后的母液中,可将Br—氧化成Br2 19.下列有关物质用途的说法错误的是 A.明矾可用作净水剂 B.氧化铝用于制造耐火坩埚 C.碳酸钡可用作医疗上检查肠胃的“钡餐” D.常温下,可用铁制容器贮运浓硝酸、浓硫酸 20.实验室中常用到0.1 mol/L的NaOH溶液,其中的“mol/L”对应的物理量是 A.溶解度 B.质量分数 C.摩尔质量 D.物质的量浓度 21.锂硫电池放电时反应为2Li+S=Li2S,其装置如右下图所示。下列关于该电池的说法正确的是 A.Li作正极 B.电池工作时Li被还原 C.电子由S经导线流向Li D.实现了化学能向电能的转化 22.短周期主族元素A、B、C、D的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,B位于第ⅤA族,A和C同主族,D原子最外层电子数与电子层数相等。下列叙述正确的是 A.原子半径:D>C>B B.单质的还原性:D>C C.元素A、B、C的氧化物均为共价化合物 D.元素B、C、D的最高价氧化物对应水化物能相互反应 23.用溴水除去甲烷气体中的少量乙烯,其原理为乙烯能与溴发生 A.取代反应 B.加成反应 C.水解反应 D.聚合反应 第Ⅱ卷(非选择题 共31分) 二、 非选择题(本部分共3题,共31分): 24.《化学与生活》(共10分) 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题。 (1)制作腐乳的主要原料是黄豆,黄豆富含人体所需的营养物质主要是_______。制作腐乳用到了加碘盐,即在食盐中加入_______(写出碘化合物的名称或化学式)。 (2)腐乳在酿制过程中会产生多种氨基酸,故味道鲜美,这些氨基酸的通式为________。腐乳虽好但不能作为主食,原因在于腐乳所含的_______类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质。 (3)盛装腐乳的陶罐属于_______(填“无机”或“有机”)非金属材料制品,陶罐的主要成分为_______酸盐。 (4)外包装纸盒所用纸的主要成分是____________。包装盒提绳的主要成分是聚丙烯塑料,由丙烯合成聚丙烯的化学方程式为:________________________。 (5)聚丙烯等材料制成的塑料制品不应随意丢弃,以免造成俗称“_________污染”的环境问题。 25.(本大题共2小题,每空1分,共7分。) (1) 如图是元素周期表的一部分,请回答下列问题。 ① Z元素在元素周期表中位于第________族。 ② Z的原子半径__________(填“大于”、“小于”或“等于”)Si的原子半径。 ③Cl元素的非金属性比Z元素的__________(填“强”或“弱”)。 ④Z元素的气态氢化物的化学式为________________。 (2)四氢硼锂(LiBH4)是一种重要的化学试剂,低温下可与HCl气体发生如下反应: -80℃ 2 LiBH4 + 2 HCl 2 LiCl + B2H6 + 2 H2 该反应中,LiBH4和B2H6中的氢元素均显-1价。请回答下列问题。 ①LiBH4中硼元素的化合价为________。 ② 该反应的还原剂为________;4 mol LiBH4完全反应后共失去_____mol电子。 26.(14分)苯是一种化工原料和溶剂,在科研和生产中应用广泛。请回答下列问题。 (1)苯易挥发且有_____,所以苯在油漆中用作溶剂不符合绿色化学的基本原则。 (2)往盛有3 mL溴水的试管中加入2 mL苯,充分振荡、静置分层后,颜色较深的是________(填“上”或“下”)层。 (3)苯分子中6个碳原子连接成平面正六边形结构,6个碳原子间的共价键完全相同。由此推测,苯分子中任意相邻2个碳原子间平均共用的电子个数是_______。 (4)过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。 过氧化钙晶体可用下列方法制备: CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。 用如下制取装置制备过氧化钙晶体。 ① 装置A中发生反应的化学方程式为 ; 仪器X的名称为 。 ② 装置C采用冰水浴控制温度在0℃左右,可能的原因主要有: Ⅰ.该反应是放热反应,温度低有利于提高CaO2·8H2O产率; Ⅱ. ③ 反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为 。查看更多