- 2021-06-04 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第四章电化学基础1原电池跟踪训练含解析 人教版选修4
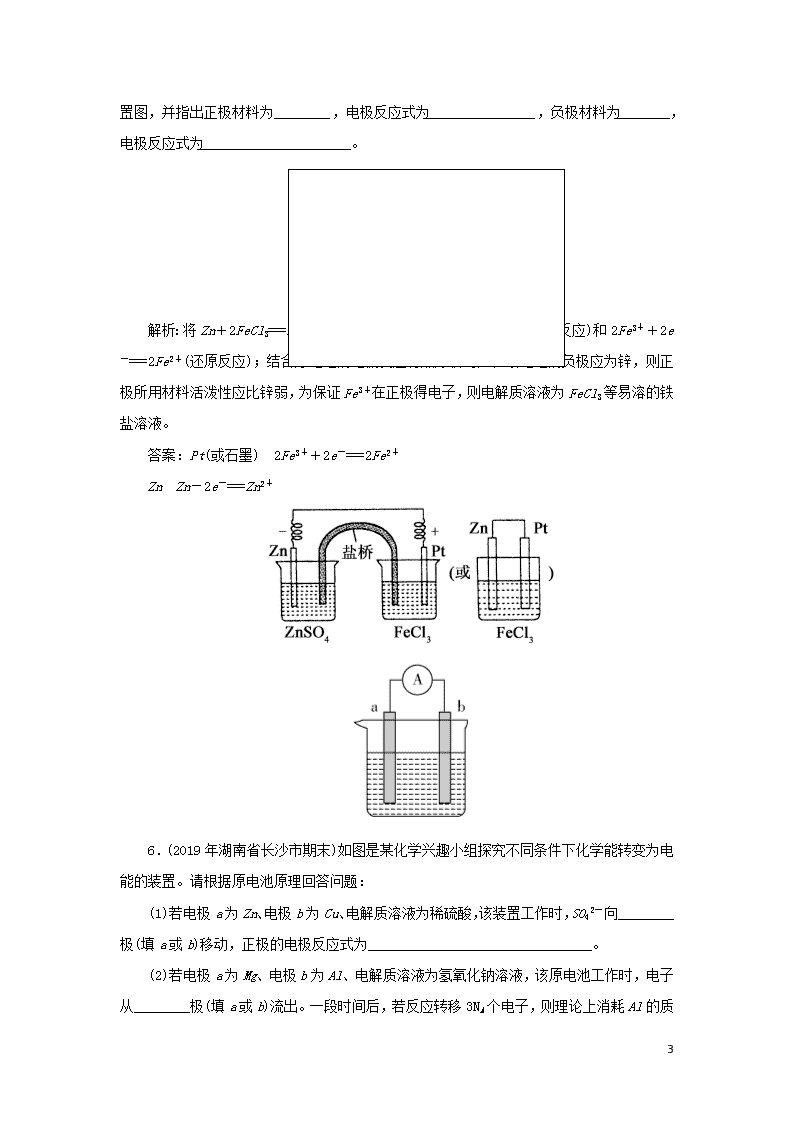
原电池 1.(2019年河南省商丘市联考)某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( ) A.a和b不连接时,铁片上会有金属铜析出 B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu C.a和b用导线连接后,溶液中的Cu2+向铜电极移动 D.a和b用导线连接后,Fe片上发生还原反应 解析:a和b不连接时,Fe与硫酸铜溶液发生置换反应,和b用导线连接时,形成原电池,Fe作负极,Cu作正极,以此解答该题。a和b不连接时,铁和铜离子发生置换反应,所以铁片上有铜析出,A正确;a和b连接时,该装置构成原电池,铜作正极,发生还原反应,铜离子得电子生成铜,电极方程式为:Cu2++2e-===Cu,B正确;a和b用导线连接时,形成原电池,原电池溶液中阳离子移向正极,即溶液中的Cu2+向铜电极移动,C正确;a和b连接时,该装置构成原电池,铁作负极,发生氧化反应,D错误。 答案:D 2.(2019年乳山市高二上学期考试)关于如图所示的原电池,下列说法正确的是( ) A.电子从铜电极通过电流计流向锌电极 B.盐桥中的阳离子向硫酸铜溶液中迁移 4 C.锌电极发生还原反应,铜电极发生氧化反应 D.铜电极上发生的电极反应是2H++2e-===H2↑ 解析:该电池中Zn为负极,发生氧化反应,电极反应式为:Zn-2e-===Zn2+,Cu作正极,发生还原反应,电极反应式为:Cu2++2e-===Cu,盐桥中阳离子移向Cu电极,阴离子移向Zn电极,B项正确。 答案:B 3.下列反应不可用于设计原电池的是( ) A.Zn+2HCl===ZnCl2+H2↑ B.4Al+3O2+6H2O===4Al(OH)3 C.NaOH+HCl===NaCl+H2O D.2CH3OH+3O2―→2CO2+4H2O 解析:可以设计成原电池的反应为可以自发进行的氧化还原反应,A、B、D可以,C为酸碱中和反应,属于非氧化还原反应,不能设计成原电池。 答案:C 4.如图所示装置,电流表G发生偏转,同时a极逐渐变粗,b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( ) A.a是Zn,b是Cu,c是稀H2SO4 B.a是Cu,b是Zn,c是稀H2SO4 C.a是Fe,b是Ag,c为AgNO3溶液 D.a是Ag,b是Fe,c为AgNO3溶液 解析:由题意,a极变粗,b极变细可知,b为负极,a为正极,溶液中阳离子在a极上得电子析出,应为金属盐溶液,a、b两金属活泼性b>a,所以A、B、C错,D正确。 答案:D 5.利用反应Zn+2FeCl3===ZnCl2+2FeCl2 4 设计一个原电池。在下图方格内画出实验装置图,并指出正极材料为________,电极反应式为________________,负极材料为________,电极反应式为______________________。 解析:将Zn+2FeCl3===ZnCl2+2FeCl2拆分为:Zn-2e-===Zn2+(氧化反应)和2Fe3++2e-===2Fe2+(还原反应);结合原电池的电极反应特点分析可知,该电池的负极应为锌,则正极所用材料活泼性应比锌弱,为保证Fe3+在正极得电子,则电解质溶液为FeCl3等易溶的铁盐溶液。 答案:Pt(或石墨) 2Fe3++2e-===2Fe2+ Zn Zn-2e-===Zn2+ 6.(2019年湖南省长沙市期末)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题: (1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,SO42-向________极(填a或b)移动,正极的电极反应式为________________________________。 (2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,该原电池工作时,电子从________极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上消耗Al 4 的质量是________g。 解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应,电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此解答。 (1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,由于金属性Zn>Cu,则锌是负极,铜是正极,所以该装置工作时,SO42-向负极即向a极移动,正极上氢离子放电,电极反应式为2H++2e-===H2↑。 (2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,由于铝能与氢氧化钠溶液反应,则铝是负极,镁是正极,因此该原电池工作时,电子从b极流出。1 mol铝在反应中失去3 mol电子,一段时间后,若反应转移3NA个电子,则理论上消耗Al的物质的量是1 mol,质量是27 g。 答案:(1)a 2H++2e===H2↑ (2)b 27 4查看更多