2020届高考化学二轮复习电解质溶液课件(71张)
题型七 电解质溶液
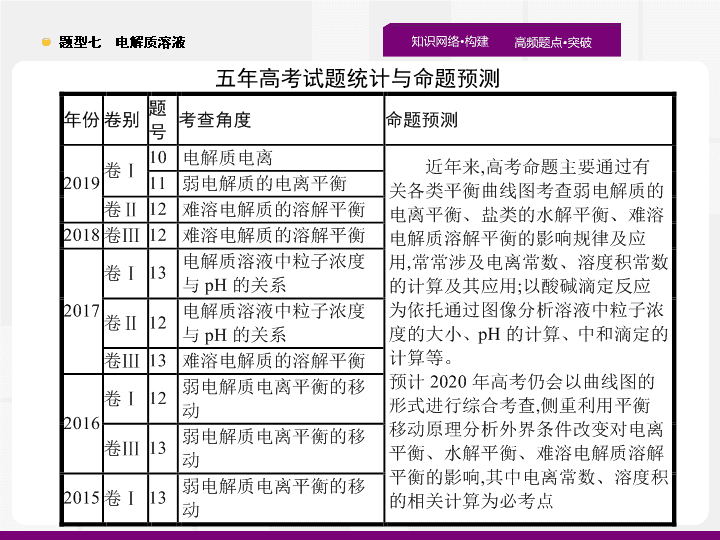
五年高考试题统计与命题
预测
题点一
题点二
题点三
真题诊断
必备知识
对点演练
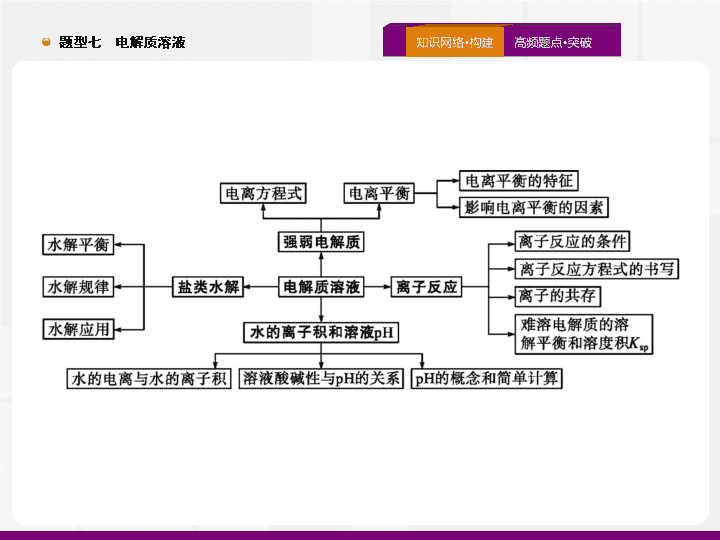
弱电解质
的电离平衡
1
.(2019·
全国
Ⅰ
,10)
固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量
HCl
气体分子在
253 K
冰表面吸附和溶解过程的示意图
,
下列叙述错误的是
(
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
冰表面第一层中
,HCl
以分子形式存在
B.
冰表面第二层中
,H
+
浓度为
5×10
-3
mol·L
-1
(
设冰的密度为
0.9 g·cm
-3
)
C.
冰表面第三层中
,
冰的氢键网络结构保持不变
D.
冰表面各层之间
,
均存在可逆反应
HCl H
+
+Cl
-
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
B
项正确
;
由图示可知
,
冰表面第三层中只有水分子
,
因此冰的氢键网络结构保持不变
,C
项正确
;
由图示可知
,
冰表面第三层中无此可逆反应
,D
项错误。
易错警示
本题容易形成思维定式
,
误以为
HCl
的电离是不可逆的
,
应结合图示第一层中存在
HCl
分子
,
第二层中
HCl
完全电离
,
故一、二层之间存在溶解平衡。
解析
:
由图示可知
,
冰表面第一层中
,HCl
以分子形式存在
,A
项正确
;
冰表面第二层中
,
c
(H
+
)=
c
(Cl
-
),
设
n
(Cl
-
)=1
mol,
则
n
(H
2
O)=1×10
4
mol,
m
(H
2
O)=18
g·mol
-1
×1×10
4
mol=1.8×10
5
g,
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.(2019·
全国
Ⅰ
,11)NaOH
溶液滴定邻苯二甲酸氢钾
(
邻苯二甲酸
H
2
A
的
K
a1
=1.1×10
-3
,
K
a2
=3.9×10
-6
)
溶液
,
混合溶液的相对导电能力变化曲线如图所示
,
其中
b
点为反应终点。下列叙述错误的是
(
)
A.
混合溶液的导电能力与离子浓度和种类有关
B.Na
+
与
A
2-
的导电能力之和大于
HA
-
的
C.b
点的混合溶液
pH=7
D.c
点的混合溶液中
,
c
(Na
+
)>
c
(K
+
)>
c
(OH
-
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
解析
:
随着
NaOH
溶液的加入
,
混合溶液中离子浓度和种类发生变化
,
因此混合溶液的导电能力与离子浓度和种类有关
,A
项正确
;a
点的混合溶液中能导电的离子主要为
HA
-
和
K
+
,b
点为反应终点
,
因此
b
点的混合溶液中能导电的离子主要为
A
2-
、
K
+
、
Na
+
,
故
Na
+
与
A
2-
的导电能力之和大于
HA
-
的
,B
项正确
;b
点的混合溶液中含有的
A
2-
能发生水解反应而使溶液呈碱性
,C
项错误
;b
点为反应终点
,
因此
b
点的混合溶液中
c
(Na
+
)=
c
(K
+
)>
c
(OH
-
),
继续加入氢氧化钠溶液后
,c
点的混合溶液中
c
(Na
+
)>
c
(K
+
)>
c
(OH
-
),D
项正确。
答案
:
C
题点一
题点二
题点三
真题诊断
必备知识
对点演练
3
.(2016·
全国
Ⅰ
,12)298 K
时
,
在
20.0 mL 0.10 mol·L
-1
氨水中滴入
0.10 mol·L
-1
的盐酸
,
溶液的
pH
与所加盐酸的体积关系如图所示。已知
0.10 mol·L
-1
氨水的电离度为
1.32%,
下列有关叙述正确的是
(
)
A.
该滴定过程应该选择酚酞作为指示剂
B.M
点对应的盐酸体积为
20.0 mL
C.M
点处的溶液中
c
(N )=
c
(Cl
-
)=
c
(H
+
)=
c
(OH
-
)
D.N
点处的溶液中
pH<12
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
D
解析
:
氨水与盐酸中和生成氯化铵
,
氯化铵属于强酸弱碱盐
,
溶液显酸性
,
应选择在酸性范围变色的指示剂
,
指示剂可以为甲基橙
,A
选项错误
;
盐酸若为
20
mL,
二者恰好中和
,
此时溶液为酸性
,
若溶液
pH=7,
则盐酸体积必然小于
20
mL,B
选项错误
;M
点处溶液呈中性
,
c
(N )=
c
(Cl
-
),
c
(H
+
)=
c
(OH
-
),
但
c
(Cl
-
)
要远大于
c
(H
+
),C
选项错误
;
由于
N
点为
0.1
mol·L
-1
的氨水
,
根据电离度为
1.32%,
c
(OH
-
)=0.1
mol·L
-1
×1.32%=0.00
132
mol·L
-1
,
故
pH<12,D
选项正确。
易错警示
M
点为溶液中性点
,
并非恰好完全反应点
;
二者恰好反应完全时溶质为
NH
4
Cl,NH
4
Cl
水解使溶液呈酸性
,
故
M
点时盐酸不足。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
4
.(2016·
全国
Ⅲ
,13)
下列有关电解质溶液的说法正确的是
(
)
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
题点一
题点二
题点三
真题诊断
必备知识
对点演练
技巧点拨
溶液中离子浓度之比的变化
,
可以通过两种方式进行比较
:
(1)
若分子、分母的离子浓度变化相反
,
则可以把浓度之比转化为微粒数目之比
,
结合平衡移动
,
作出判断。
(2)
若分子、分母的离子浓度变化趋势一致
,
无法直接判断
,
可通过平衡常数表达式的变形
,
转化为可比形式进行比较。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
5
.(2015·
全国
Ⅰ
,13)
浓度均为
0.10 mol·L
-1
、体积均为
V
0
的
MOH
和
ROH
溶液
,
分别加水稀释至体积
V
,pH
随
lg
的
变化如图所示。下列叙述错误的是
(
)
A.MOH
的碱性强于
ROH
的碱性
B.ROH
的电离程度
:
b
点大于
a
点
C.
若两溶液无限稀释
,
则它们
的
c
(OH
-
)
相等
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
D
解析
:
由图像知
,0.10
mol·L
-1
的
MOH
溶液的
pH
为
13,
说明
MOH
为强碱
,ROH
溶液的
pH
小于
13,
说明
ROH
为弱碱
,
所以
MOH
的碱性强于
ROH
的碱性
,A
选项正确
;
稀释有利于弱电解质的电离
,
故
B
选项正确
;
若两溶液无限稀释则接近中性
,
则它们的
c
(OH
-
)
相等
,C
选项正确
;
当
lg =2
时
,MOH
溶液的
pH
为
11,ROH
溶液的
pH
为
10,
若两溶液同时升高温度
,ROH
溶液中存在电离平衡
,
平衡会右移
,
c
(R
+
)
增大
,
c
(M
+
)
不变
,
故比值减小
,D
项错误。
方法点拨
0.1
mol·L
-1
的一元碱
,
曲线的起点确定碱的强弱
,
据此分清
“
强弱
”
也就找到了解决问题突破口。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
1
.
强弱电解质溶液的稀释与
pH
变化关系的图像
(1)
相同体积、相同浓度盐酸、醋酸的
稀释
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(2)
相同体积、相同
pH
盐酸、醋酸的
稀释
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(3)pH
与稀释倍数的
线性关系
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.
电离常数的计算与应用
对于二元弱酸
——H
2
A
②
电离常数与水解常数关系
以二元酸的一级电离常数
K
a1
与酸式盐的水解常数
K
h
关系为例
:
题点一
题点二
题点三
真题诊断
必备知识
对点演练
1
.(2019·
山西运城模拟
)25
℃
条件下
,
部分弱酸的电离常数如下表所示。下列有关说法不正确的是
(
)
B.
相同
pH
的
HCOONa
和
NaClO
溶液中离子总浓度前者大
C.
等浓度等体积的
Na
2
S
溶液和
HCOOH
溶液混合后
:
c
(Na
+
)=2
c
(HCOO
-
)+2
c
(HCOOH)
D.
向
NaClO
溶液中通入
H
2
S,
发生的反应为
:H
2
S+NaClO=HClO+NaHS
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
解析
:
由表中电离常数可知
,
酸性强弱顺序为
:HCOOH>H
2
S>HClO>HS
-
,
则对应离子的水解程度由大到小顺序为
:S
2-
>ClO
-
>HS
-
>HCOO
-
。要注意
NaClO
具有强氧化性
,
与
H
2
S
在溶液中发生氧化还原反应
,
不能发生复分解反应。
项正确
;
由电离常数可知
HCOOH
比
HClO
易电离
,
则等体积、等浓度的
HCOONa
和
NaClO
溶液中
ClO
-
水解程度更大
,NaClO
溶液的
pH
大
,
所以
pH
相同时
c
(HCOONa)>
c
(NaClO),
即
HCOONa
溶液中离子总浓度大于
NaClO
溶液中离子总浓度
,B
项正确
;
等物质的量的
Na
2
S
和
HCOOH
混合后生成等物质的量的
NaHS
和
HCOONa,
物料守恒关系为
c
(Na
+
)=2
c
(HCOO
-
)+2
c
(HCOOH),C
项正确
;
向
NaClO
溶液中通入
H
2
S,
因
NaClO
具有强氧化性
,
与
H
2
S
在溶液中发生氧化还原反应
,
并不是发生复分解反应
,D
项错误。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.(2019·
河南部分示范性高中联考
)
常温下
,
向
10 mL 1 mol·L
-1
一元酸
HA
溶液中
,
不断滴加
1 mol·L
-1
的
NaOH
溶液
,
所加碱溶液的体积与
-lg
c
水
(H
+
)
的关系如图所示。
c
水
(H
+
)
为溶液中水电离的
c
(H
+
)
。下列说法不正确的是
(
)
A.
常温下
,
K
a
(HA)
的数量级为
10
-4
B.a
、
b
两点
pH
均为
7
C.
从
a
点到
b
点
,
水的电离程度先增大后减小
D.
反应开始至反应完全范围内
,
溶液
的导电性逐渐增强
答案
:
B
题点一
题点二
题点三
真题诊断
必备知识
对点演练
解析
:
由起点溶液中
-lg
c
水
(H
+
)=12
可知
,
c
水
(H
+
)=
c
(OH
-
)=1×10
-12
mol·L
-1
,
则酸电离的
c
(H
+
)=10
-2
mol·L
-1
,
故
K
a
(HA)=10
-4
,A
项正确
;
由
1
mol·L
-1
HA
溶液中
c
(H
+
)=10
-2
mol·L
-1
可知
,HA
是弱酸
,
曲线的最高点为
NaA
溶液
,b
点溶液中的溶质是
NaA
和
NaOH,
溶液呈碱性
,pH>7,B
项错误
;a
点到
b
点
,
先是发生酸碱中和反应生成可水解的盐
,
然后碱过量
,
所以水的电离程度先增大后减小
,C
项正确
;
不断加入
NaOH
溶液
,
溶液中的离子总浓度不断增大
,
溶液的导电性逐渐增强
,D
项正确。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
3
.(2019·
河北衡水中学模拟
)
T
℃
,
分别向
10 mL
浓度均为
1 mol·L
-1
的两种弱酸
HA
、
HB
溶液中不断加水稀释
,
并用
pH
传感器测定溶液
pH
。所得溶液
pH
的两倍
(2pH)
与溶液浓度的对数
(lg
c
)
关系如图所示。下列叙述正确的是
(
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
弱酸的
K
a
随溶液浓度的降低而增大
B.a
点对应的溶液中
c
(HA)=0.1 mol·L
-1
,pH=2
C.
酸性
:HA
HB,C
项错误
;
根据图像看出
,
当
lg
c
=0
时
,
c
(HB)=1
mol·L
-1
,2pH=5,
则
pH=2.5,
c
(H
+
)=1×10
-2.5
mol·L
-1
,HB
的
题点一
题点二
题点三
真题诊断
必备知识
对点演练
4
.(2019·
辽宁葫芦岛一模
)25
℃
时
,
将浓度均为
0.1 mol·L
-1
、体积分别为
V
a
和
V
b
的
HA
溶液与
BOH
溶液按不同体积比混合
,
保持
V
a
+
V
b
=100 mL,
V
a
、
V
b
与混合液的
pH
的关系如图所示。下列说法正确的是
(
)
A.
K
a
(HA)=
K
b
(BOH)=1×10
-6
B.b
点时
,
c
(A
-
)=
c
(B
+
)=
c
(H
+
)=
c
(OH
-
)
C.c
点时
,
c
(A
-
)>
c
(B
+
)
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
题点一
题点二
题点三
真题诊断
必备知识
对点演练
电解质溶液中粒子浓度与
pH
的关系
1.(
2017·
全国
Ⅰ
,13)
常温下
,
将
NaOH
溶液滴加到己二酸
(H
2
X)
溶液中
,
混合溶液的
pH
与离子浓度变化的关系如图所示。下列叙述错误的是
(
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
K
a2
(H
2
X)
的数量级为
10
-6
C.NaHX
溶液中
c
(H
+
)>
c
(OH
-
)
D.
当混合溶液呈中性时
,
c
(Na
+
)>
c
(HX
-
)>
c
(X
2-
)>
c
(OH
-
)=
c
(H
+
)
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
题点一
题点二
题点三
真题诊断
必备知识
对点演练
疑难突破
有关图像
问题
(2)
二看曲线的走向
,
随着粒子浓度比值的增大
,
酸性渐弱。
(3)
三看曲线上的特殊点
,
选择合适的点进行分析、计算。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.(2017·
全国
Ⅱ
,12)
改变
0.1 mol·L
-1
二元弱酸
H
2
A
溶液的
pH,
溶液中
H
2
A
、
HA
-
、
A
2-
的物质的量分数
δ
(X)
随
pH
的变化如图所
下列叙述错误的是
(
)
A.pH=1.2
时
,
c
(H
2
A)=
c
(HA
-
)
B.lg[
K
2
(H
2
A)]=-4.2
C.pH=2.7
时
,
c
(HA
-
)>
c
(H
2
A)=
c
(A
2-
)
D.pH=4.2
时
,
c
(HA
-
)=
c
(A
2-
)=
c
(H
+
)
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
解析
:
A
项
,
根据图像
,pH=1.2
时
,H
2
A
和
HA
-
物质的量分数相同
,
则有
c
(H
2
A)=
c
(HA
-
),A
正确
;B
项
,
根据
pH=4.2
时
,HA
-
物质的量分数最大
,H
2
A
和
A
2-
物质的量分数基本相同
,
则有
c
(HA
-
)>
c
(H
2
A)=
c
(A
2-
),C
正确
;D
项
,
根据
pH=4.2
时
,
c
(HA
-
)=
c
(A
2-
),
且物质的量分数约为
0.48,
而
c
(H
+
)=10
-4.2
mol·L
-1
,
可知
c
(HA
-
)=
c
(A
2-
)>
c
(H
+
),D
错误。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
3
.(2019·
北京理综
,12)
实验测得
0.5 mol·L
-1
CH
3
COONa
溶液、
0.5 mol·L
-1
CuSO
4
溶液以及
H
2
O
的
pH
随温度变化的曲线如图所示。下列说法正确的是
(
)
A.
随温度升高
,
纯水中
c
(H
+
)>
c
(OH
-
)
B.
随温度升高
,CH
3
COONa
溶液的
c
(OH
-
)
减小
C.
随温度升高
,CuSO
4
溶液的
pH
变化是
K
W
改变与水解平衡移动共同作用的结果
D.
随水温升高
,CH
3
COONa
溶液和
CuSO
4
溶液的
pH
均降低
,
是因为
CH
3
COO
-
、
Cu
2+
水解平衡移动方向不同
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
C
解析
:
随温度升高
,
K
W
增大
,
但纯水中的
c
(H
+
)
仍然等于
c
(OH
-
),A
错误
;
随温度升高
,CH
3
COONa
水解平衡和水的电离平衡均会正向移动
,
c
(OH
-
)
增大
,
图中
pH
略有减小
,
应是水的电离平衡正向移动所致
,B
错误
;
随温度升高
,CuSO
4
水解程度增大
,
c
(H
+
)
增大
,pH
减小
,
而且升温也会导致水的电离平衡正向移动
,
K
W
增大
,C
正确
;D
项
,
随水温升高
,CH
3
COO
-
、
Cu
2+
水解平衡均正向移动
,D
错误。
特别提醒
本题将醋酸钠溶液、硫酸铜溶液和水的
pH
随温度升高变化的情况以图示的方式展现出来
,
意在引导考生综合分析温度变化对水的电离和盐的水解产生的影响
,
不能简单以溶液
pH
的变化衡量溶液酸碱性的变化。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
1
.
电解质溶液图像类型
(1)
酸碱中和滴定曲线
“
五点
”
突破法
题点一
题点二
题点三
真题诊断
必备知识
对点演练
例如
:
室温下
,
向
20 mL 0.1 mol·L
-1
HA
溶液中逐滴加入
0.1 mol·L
-1
NaOH
溶液
,
溶液
pH
的变化如图所示
:
题点一
题点二
题点三
真题诊断
必备知识
对点演练
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(2)
双曲线型图像
不同温度下水溶液中
c
(H
+
)
与
c
(OH
-
)
的变化曲线
①
A
、
C
、
B
三点均为中性
,
温度依次升高
,
K
W
依次增大
②
D
点为酸性溶液
,E
点为碱性溶液
,
K
W
=1×10
-14
③
AB
直线的左上方均为碱性溶液
,
任意一点
:
c
(H
+
)<
c
(OH
-
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(3)
分布系数图像
随着溶液
pH
的变化
(
横坐标
),
溶液中组分的平衡浓度占总浓度的分数
(
纵坐标
)
。草酸
H
2
C
2
O
4
的分布图如下
:
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.
电解质溶液中的三大守恒
(1)
电荷守恒
建立电荷守恒关系
,
要找全溶液中的阴、阳离子
,
分列等式两边
,
切勿漏写
;
离子所带电荷数不是
1
时
,
要在该离子物质的量浓度前乘以其所带的电荷数。
如一定温度下
,pH=2
的
H
2
C
2
O
4
溶液与
pH=12
的
NaOH
溶液任意比例混合
,
离子浓度关系为
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(2)
物料守恒
以元素
X
、
Y
的物料关系书写守恒式时
,
要分别找全含有
X
、
Y
的微粒
,
分列等式两边
,
切勿漏写
;
准确确定
X
与
Y
的物料关系
,
不要弄反两者的计量数之比
,
不要忽略新加入物质对溶液的影响。
如室温下
,0.10 mol·L
-1
Na
2
SO
3
溶液中存在
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(3)
质子守恒
方法一
:
找出所有能够提供
H
+
的微粒
,
包括
H
2
O,
等式左边书写这些微粒失去
H
+
后形成的微粒
(
注意若失去
2
个
H
+
,
则该微粒的物质的量浓度前要乘以计量数
2,
且不要漏掉
OH
-
);
右边书写与
H
+
结合后形成的微粒
(
若结合
2
个
H
+
,
则该微粒的物质的量浓度前也要乘以计量数
2,
另外不要漏掉
H
+
)
。如
NaHCO
3
溶液中存在
:
方法二
:
代入法构建等式
,
即将物料守恒式与电荷守恒式联立
,
得出质子守恒式。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
1
.(2019·
辽宁辽阳二模
)
常温下
,
将
NaOH
溶液滴入某一元酸
(HA)
溶液中
,
测得混合溶液的
pH
与离子浓度变化关系如图所示
[
已
A.
K
a
(HA)
的数量级为
10
-5
C.m
点所示溶液中
:
c
(H
+
)+
c
(Na
+
)=
c
(HA)+
c
(OH
-
)
D.n
点所示溶液中
:
c
(Na
+
)=
c
(A
-
)+
c
(HA)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
D
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.(2019·
湖南怀化二模
)
常温下
,
将
V
0
mL 1 mol·L
-1
HClO
2
和
V
0
mL 1 mol·L
-1
HMnO
4
两种酸溶液分别加水稀释
,
稀释后溶液体积为
V
,
稀释液
pH
与其体积变化的关系如图所示。下列说法正确的是
(
)
A.HClO
2
和
HMnO
4
均为一元
弱酸
题点一
题点二
题点三
真题诊断
必备知识
对点演练
C.
分别往
M
、
N
两点对应溶液中滴加
1 mol·L
-1
NaOH
溶液至恰好完全反应
,
消耗
NaOH
溶液的体积相等
D.
常温下
,
浓度均为
0.1 mol·L
-1
的
NaClO
2
和
NaMnO
4
溶液
,
溶液
pH:NaMnO
4
>NaClO
2
答案
:
C
解析
:
由题图可知
,1
mol·L
-1
HClO
2
溶液的
pH>1,1
mol·L
-1
HMnO
4
的
pH=0,
说明
HClO
2
是弱酸
,HMnO
4
为强酸
,A
项错误
;
因为
错误
;
同体积同浓度
HClO
2
、
HMnO
4
中和
1
mol·L
-1
的
NaOH
溶液的能力相同
,C
项正确
;
酸性
:HClO
2
7,NaMnO
4
不水解溶液显中性
,D
项错误。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
3
.(2019·
贵州遵义航天高级中学最后一卷
)
常温下
,
某实验小组探究碳酸氢铵溶液中各微粒物质的量浓度随溶液
pH
的变化如图所示
(
忽略溶液体积变化
),
则下列说法错误的是
(
)
各种粒子浓度变化趋势
A.
由图可知碳酸的
K
a1
数量级约为
10
-7
B.
向
NH
4
HCO
3
溶液中加入过量的
NaOH
溶液
,
主要与
HC
反应
C.
常温下将
NH
4
HCO
3
固体溶于水
,
溶液显碱性
D.NH
4
HCO
3
作肥料时不能与草木灰混用
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
B
题点一
题点二
题点三
真题诊断
必备知识
对点演练
4
.(2019·
湖南衡阳三中模拟
)
类比
pH
的定义
,
对于稀溶液可以定义
p
c
=-lg
c
,p
K
a
=-lg
K
a
。常温下
,
某浓度
H
2
A
溶液在不同
pH
下
,
测得
p
c
(H
2
A)
、
p
c
(HA
-
)
、
p
c
(A
2-
)
变化如图所示。下列说法正确的是
(
)
A.pH=3.50
时
,
c
(H
2
A)>
c
(HA
-
)>
c
(A
2-
)
B.
将等浓度等体积的
Na
2
A
与
H
2
A
溶液混合后
,
溶液显碱性
D.pH
从
3.00
到
5.30
时
,
c
(H
2
A)+
c
(HA
-
)+
c
(A
2-
)
先增大后减小
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
C
题点一
题点二
题点三
真题诊断
必备知识
对点演练
难溶电解质的溶解平衡
1
.(2019·
全国
Ⅱ
,12)
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉
(CdS)
是一种难溶于水的黄色颜料
,
其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
(
)
A.
图中
a
和
b
分别为
T
1
、
T
2
温度下
CdS
在水中的溶解度
B.
图中各点对应的
K
sp
的关系为
:
K
sp
(m)=
K
sp
(n)<
K
sp
(p)<
K
sp
(q)
C.
向
m
点的溶液中加入少量
Na
2
S
固体
,
溶液组成由
m
沿
mpn
线向
p
方向移动
D.
温度降低时
,q
点的饱和溶液的组成由
q
沿
qp
线向
p
方向移动
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
B
解析
:
CdS
在水中存在沉淀溶解平衡
:CdS(s
) Cd
2
+
(aq)+S
2-
(aq),
电离出的
S
2-
浓度与
Cd
2+
浓度相同
,A
项正确
;
沉淀溶解平衡常数只与温度有关
,
温度相同
,
K
sp
相同
,
所以
m
、
p
、
n
三点的
K
sp
相同
,B
项错误
;
在
T
1
温度下
,
向
m
点的溶液中加入少量
Na
2
S
固体
,S
2-
浓度增大
,
但由于
K
sp
不变
,
所以
Cd
2+
浓度必然减小
,
因此溶液组成由
m
沿
mpn
线向
p
方向移动
,C
项正确
;
温度降低
,CdS
的
K
sp
减小
,
但
S
2-
浓度与
Cd
2+
浓度仍然相等
,
所以
q
点饱和溶液的组成由
q
沿
qp
线向
p
方向移动
,D
项正确。
特别提醒
溶解平衡曲线上的任意一点均为平衡点
,
同一曲线上的不同点
,
离子浓度有差异
,
但是溶度积相同
,
因为溶度积除由难溶电解质本身性质决定外
,
只受温度影响。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.(2018·
全国
Ⅲ
,12)
用
0.100 mol·L
-1
AgNO
3
滴定
50.0 mL 0.050 0 mol·L
-1
Cl
-
溶液的滴定曲线如图所示。下列有关描述错误的是
(
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
根据曲线数据计算可知
K
sp
(AgCl)
的数量级为
10
-10
B.
曲线上各点的溶液满足关系式
c
(Ag
+
)·
c
(Cl
-
)=
K
sp
(AgCl)
C.
相同实验条件下
,
若改为
0.040 0 mol·L
-1
Cl
-
,
反应终点
c
移到
a
D.
相同实验条件下
,
若改为
0.050 0 mol·L
-1
Br
-
,
反应终点
c
向
b
方向移动
答案
:
C
解析
:
相同实验条件下
,
若改为
0.040
0
mol·L
-1
Cl
-
,
恰好反应时
,0.040
0
mol·L
-1
×50.0
mL=0.100
mol·L
-1
·
V
,
V
=20
mL,
故反应终点横坐标应为
20,C
项描述错误
;
相同实验条件下
,
若改为
0.050
0
mol·L
-1
Br
-
,
反应终点横坐标不变
,
由于
K
sp
(AgCl)>
K
sp
(AgBr),
故反应终点纵坐标变大
,
故
D
项描述正确。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
3
.(2017·
全国
Ⅲ
,13)
在湿法炼锌的电解循环溶液中
,
较高浓度的
Cl
-
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入
Cu
和
CuSO
4
,
生成
CuCl
沉淀从而除去
Cl
-
。根据溶液中平衡时相关离子浓度的关系图
,
下列说法错误的是
(
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
K
sp
(CuCl)
的数量级为
10
-7
B.
除
Cl
-
反应为
Cu+Cu
2+
+2Cl
-
=2CuCl
C.
加入
Cu
越多
,Cu
+
浓度越高
,
除
Cl
-
效果越好
D.2Cu
+
=Cu
2+
+Cu
平衡常数很大
,
反应趋于完全
答案
:
C
解析
:
A
项
,
K
sp
(CuCl)=
c
(Cu
+
)·
c
(Cl
-
),
K
sp
(CuCl)
仅与温度有关
,
为方便计算
,
取横坐标为
1
时
,
即
c
(Cl
-
)=0.1
mol·L
-1
,
对应的
c
(Cu
+
)
约为
10
-6
mol·L
-1
,
所以
K
sp
(CuCl)
的数量级约为
0.1×10
-6
=10
-7
,
正确
;B
项
,Cu
2+
和
Cu
发生归中反应生成
Cu
+
,Cu
+
与
Cl
-
结合生成
CuCl
沉淀
,
为
1.5
时对应的值
,
可得
K
值大于
10
5
,
则该反应趋于完全
,D
正确。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
方法点拨
记住两个关键数据
,
平衡常数大于
10
5
的反应
,
说明反应基本完全
,
认为是不可逆反应
;
沉淀溶液中的离子时
,
当离子浓度小于
1×10
-5
mol·L
-1
时
,
可认为沉淀已经完全。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
1
.
沉淀溶解平衡的三类应用
(1)
沉淀的生成
①
加入沉淀剂
,
如向
AgNO
3
溶液中加入
NaCl
可生成沉淀
;
②
调节
pH,
如除去一定浓度
CuSO
4
和
FeSO
4
的混合溶液中的
FeSO
4
,
先加入
H
2
O
2
氧化
FeSO
4
,
使
Fe
2+
转化为
Fe
3+
,
再加入
CuO
或
Cu(OH)
2
调节溶液
pH
至约等于
4,
使
Fe
3+
的水解平衡右移转化为
Fe(OH)
3
沉淀
,
而此时
Cu
2+
没有沉淀
,
从而达到除杂的目的。
(2)
沉淀的溶解
①
酸溶法
,
如
CaCO
3
溶于盐酸
;
②
盐溶液溶解法
,
如
Mg(OH)
2
溶于
NH
4
Cl
溶液
;
③
氧化还原溶解法
,
如
Ag
2
S
溶于稀硝酸
;
④
配位溶解法
,
如
AgCl
溶于氨水。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(3)
沉淀的转化
溶解能力相对较强的物质易向溶解能力相对较弱的物质转化
,
如
2
.
溶解度曲线解题要点
(1)
沉淀溶解平衡曲线类似于溶解度曲线
,
曲线上任一点都表示饱和溶液
;
曲线上方的任一点均表示溶液过饱和
,
此时有沉淀析出
;
曲线下方的任一点均表示不饱和溶液。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
(2)
从图像中找到数据
,
根据
K
sp
公式计算得出
K
sp
的值。
(3)
比较溶液的
Q
c
与
K
sp
的大小
,
判断溶液中有无沉淀析出。
(4)
涉及
Q
c
的计算时
,
所代入的离子浓度一定是混合溶液中的离子浓度
,
因此
,
计算离子浓度时
,
所代入的溶液体积必须是混合溶液的体积。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
向该体系中分别加入饱和
NaOH
溶液和饱和碳酸钠溶液
,
沉淀溶解平衡均向右移动
B.
分析可知
T
1
>T
2
>T
3
C.
升高温度
,
溶浸速率增大
,
平衡向右移动
答案
:
D
解析
:
加入饱和
NaOH
溶液和饱和碳酸钠溶液
,Mg
2+
和
Ca
2+
浓度减小
,
溶解平衡向右移动
,A
项正确
;
温度越高
,
溶浸速率越大
,
达到平衡所需要时间越短
,
由图示可知温度由高到低的顺序为
T
1
>T
2
>T
3
,B
项正确
;
由图像可知
,
温度越高
,K
+
的浸出浓度越大
,
说明溶解平衡吸热
,
故升高温度
,
溶浸速率增大
,
平衡正向移动
,C
项正确
;K
2
SO
4
·MgSO
4
·2CaSO
4
是纯固体
,
该物质的
题点一
题点二
题点三
真题诊断
必备知识
对点演练
2
.(2019·
湖北武汉调研
)
常温下
,
向
10 mL 0.1 mol·L
-1
CuCl
2
溶液中滴加
0.1 mol·L
-1
Na
2
S
溶液
,
滴加过程中
-lg
c
(Cu
2+
)
与
Na
2
S
溶液体积
(
V
)
的关系如图所示。下列说法错误的是
(
)
A.
K
sp
(CuS)
的数量级为
10
-35
B.
曲线上的各点均满足关系式
c
(S
2-
)·
c
(Cu
2+
)=
K
sp
(CuS)
C.a
、
b
、
c
三点中
,
由水电离的
c
(H
+
)
和
c
(OH
-
)
的积最小的为
b
点
D.c
点溶液中
:
c
(Na
+
)>
c
(Cl
-
)>
c
(S
2-
)>
c
(OH
-
)>
c
(H
+
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
A
液的体积越大
,
c
(S
2-
)
越大
,
c
(Cu
2+
)
越小
,
则
-lg
c
(Cu
2+
)
就越大
,
由于温度不变
,
所以曲线上的各点均满足关系式
c
(S
2-
)·
c
(Cu
2+
)=
K
sp
(CuS),B
项正确
;a
点
Cu
2+
过量
,c
点
S
2-
过量
,b
点恰好完全反应生成
CuS
和
NaCl,a
点溶液中
Cu
2+
浓度远大于
b
点
,c
点溶液中
S
2-
浓度远大于
b
点
,Cu
2+
、
S
2-
水解促进水的电离
,
则
b
点水电离的
c
(H
+
)
和
c
(OH
-
)
的积最小
,C
项
题点一
题点二
题点三
真题诊断
必备知识
对点演练
正确
;c
点为
Na
2
S
、
NaCl
按物质的量比
1
∶
2
混合的溶液
,
其中
CuS
处于沉淀溶解平衡状态
,
根据物料守恒及物质的溶解性
,
可知
c
(Na
+
)>
c
(Cl
-
)>
c
(S
2-
),S
2-
水解消耗水电离产生
H
+
,
使溶液中
c
(OH
-
)>
c
(H
+
),
但水电离产生的离子浓度远小于盐电离产生的离子浓度
,
故
c
(S
2-
)>
c
(OH
-
),
因此该溶液中微粒浓度大小关系为
:
c
(Na
+
)>
c
(Cl
-
)>
c
(S
2-
)>
c
(OH
-
)>
c
(H
+
),D
项正确。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
3
.(2019
广东佛山模拟
)
一定温度下
,
三种碳酸盐
MCO
3
(M:Mg
2+
、
Ca
2+
、
Mn
2+
)
的沉淀溶解平衡曲线如图所示。已
题点一
题点二
题点三
真题诊断
必备知识
对点演练
答案
:
B
题点一
题点二
题点三
真题诊断
必备知识
对点演练
4
.(2019·
湘赣十四校联考第一次考试
)25
℃
时
,Fe(OH)
2
和
Cu(OH)
2
的饱和溶液中
,
金属阳离子的物质的量浓度的负对数
[-lg
c
(M
2+
)]
与溶液
pH
的变化关系如图所示
,
已知该温度下
K
sp
[Cu(OH)
2
]<
K
sp
[Fe(OH)
2
]
。下列说法不正确的是
(
)
题点一
题点二
题点三
真题诊断
必备知识
对点演练
A.
K
sp
[Cu(OH)
2
]
的数量级为
10
-20
B.
当
Fe(OH)
2
和
Cu(OH)
2
沉淀共存时
,
溶液中
c
(Fe
2+
)
∶
c
(Cu
2+
)=10
4.6
∶
1
C.
除去
CuSO
4
溶液中含有的少量
Fe
2+
,
可加入适量
CuO
D.
向
Z
点对应的饱和溶液中加入少量
NaOH
固体
,
可转化为
Y
点对应的溶液
答案
:
C
解析
:
25
℃
时
,
由
K
sp
[Cu(OH)
2
]<
K
sp
[Fe(OH)
2
]
可知溶液
pH
相同时
,
饱和溶液中
c
(Fe
2+
)>
c
(Cu
2+
),
则曲线
a
表示
Cu(OH)
2
饱和溶液中金属阳离子的物质的量浓度的负对数与溶液
pH
的变化关系
,
曲线
b
表示
Fe(OH)
2
饱和溶液中金属阳离子的物质的量浓度的负对数与溶液
pH
的变化关系。
题点一
题点二
题点三
真题诊断
必备知识
对点演练
曲线
a
表示
Cu(OH)
2
饱和溶液中金属阳离子的物质的量浓度的负对数与溶液
pH
的变化关系
,
由图可知
,
当
pH=10
时
,-lg
c
(M
2+
)=11.7,
则
K
sp
[Cu(OH)
2
]=
c
(Cu
2+
)
c
2
(OH
-
)=10
—11.7
×(10
—4
)
2
=10
—19.7
,A
项正确
;
当
Fe(OH)
2
和
Cu(OH)
2
沉淀共存时
,
溶液中
c
(OH
-
)
相同
,
当
pH=10
时
,
溶液中
c
(Fe
2+
)
∶
c
(Cu
2+
)=10
—7.1
∶
10
—11.7
=10
4.6
∶
1,B
项正确
;
由该温度下
K
sp
[Cu(OH)
2
]<
K
sp
[Fe(OH)
2
]
可知
,Cu(OH)
2
比
Fe(OH)
2
更难溶
,
加入适量
CuO
调节溶液
pH,
先沉淀的是
Cu
2+
,
无法达到除去少量
Fe
2+
的目的
,C
项错误
;
向
Z
点对应的饱和溶液中加入少量
NaOH
固体
,
溶液中
c
(OH
-
)
增大
,
温度不变
K
sp
[Fe(OH)
2
]
不变
,
c
(Fe
2+
)
减小
,
可能由
Z
点转化为
Y
点
,D
项正确。