- 2021-06-03 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学总复习 专题检测题七(及答案)
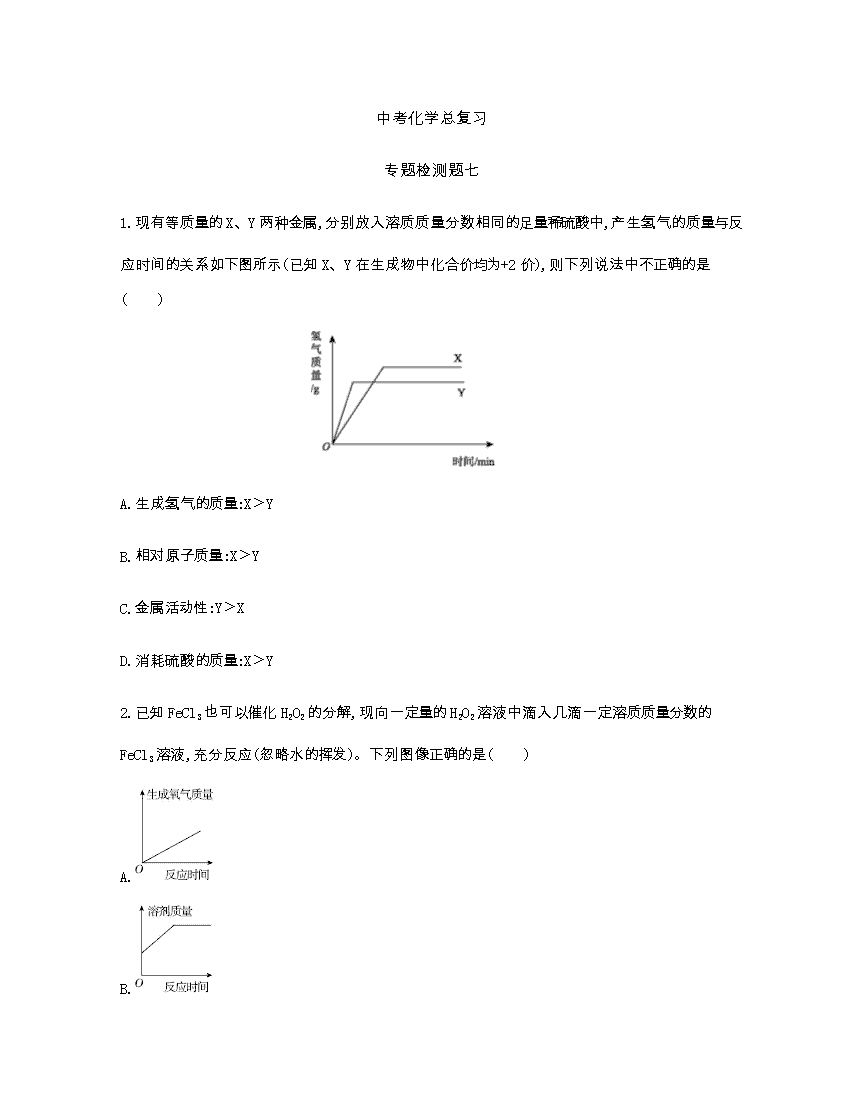
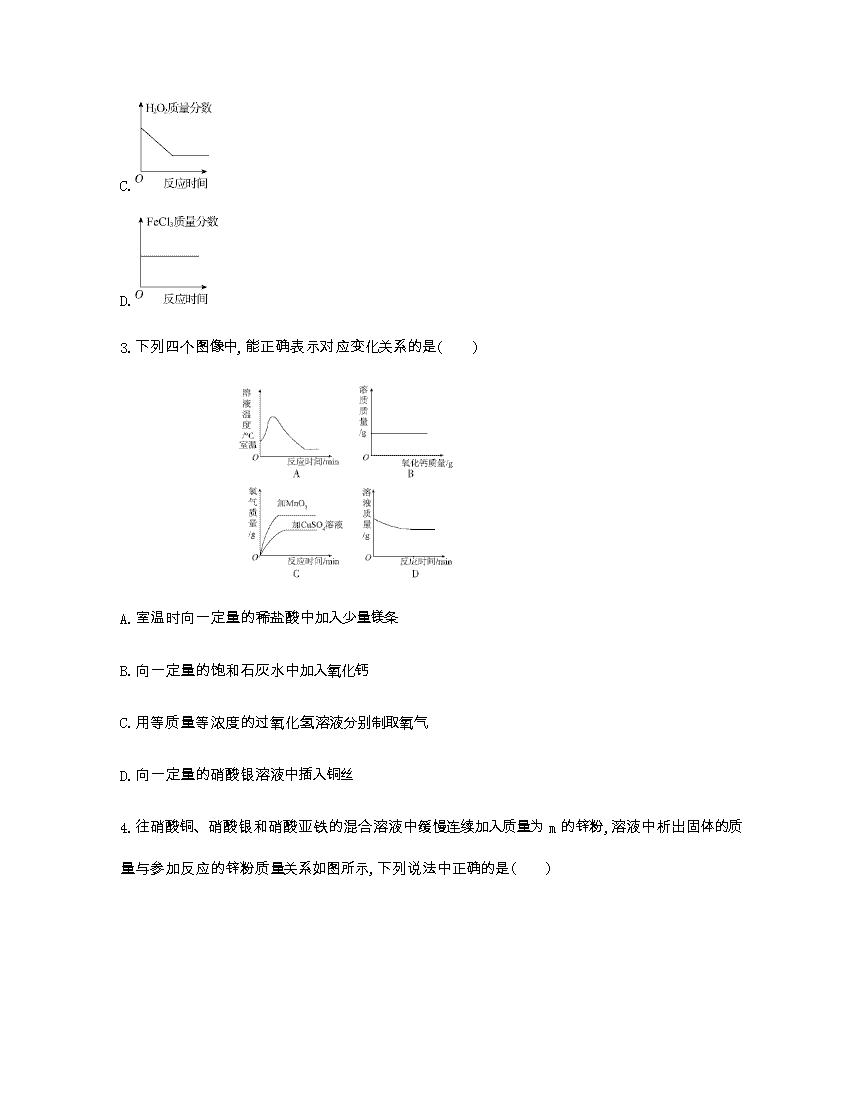
中考化学总复习 专题检测题七 1.现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如下图所示(已知X、Y在生成物中化合价均为+2价),则下列说法中不正确的是( ) A.生成氢气的质量:X﹥Y B.相对原子质量:X﹥Y C.金属活动性:Y﹥X D.消耗硫酸的质量:X﹥Y 2.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发)。下列图像正确的是( ) A. B. C. D. 3.下列四个图像中,能正确表示对应变化关系的是( ) A.室温时向一定量的稀盐酸中加入少量镁条 B.向一定量的饱和石灰水中加入氧化钙 C.用等质量等浓度的过氧化氢溶液分别制取氧气 D.向一定量的硝酸银溶液中插入铜丝 4.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( ) A.c点对应溶液中含有的金属离子为Zn2+和Cu2+ B.bc段(不含两端点)析出的金属是Fe C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+ D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1>m2 5.下图是a、b、c三种固体物质的溶解度曲线,下列叙述正确的是( ) A.将a、b、c三种物质t1℃时的饱和溶液升温至t2℃,所得溶液的溶质质量分数大小关系是a>b>c B.t2℃时30 g物质a加入到50 g水中不断搅拌,形成80 g溶液 C.t1℃时a、b、c三种物质的饱和溶液中含有溶质质量按由小到大的顺序排列是b>a=c D.若a中混有少量c,可以采用冷却热饱和溶液的方法提纯a 6.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如下图所示。下列说法正确的是( ) A.图中a点所示溶液中,含有的溶质是NaCl和NaOH B.由a点到b点的pH变化过程证明酸和碱发生了中和反应 C.向图中c点所示溶液中滴加无色酚酞,溶液不变色 D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中 7.有一包白色固体粉末,可能含有CuSO4、BaCl2、Na2SO4、Na2CO3、NaCl中的一种或几种,某同学对其组成进行了探究,过程如下,根据以下实验操作与现象,该同学得出的结论不正确的是( ) A.无色溶液F中只有NaCl B.沉淀B的化学式为BaSO4 C.原混合物中一定不含CuSO4 D.原混合物中一定含有BaCl2、Na2SO4、Na2CO3 8.20 g硫酸镁溶液中混有少量硫酸,往该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9 g氢氧化镁沉淀。沉淀的质量变化如图所示。 (1)求20 g溶液中硫酸镁的质量分数。 [反应的化学方程式为MgSO4+2NaOHMg(OH)2↓+Na2SO4] (2)氢氧化钠的质量 g时,反应不产生沉淀,其原因是 。 9.某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。下图表示用该氢氧化钠溶液与10 g某稀盐酸发生反应时溶液温度的变化情况。试计算稀盐酸中溶质的质量分数。 10.甲、乙、丙三种固体物质的溶解度曲线如下图所示,请回答下列问题。 (1)a3℃时,三种物质的溶解度由大到小的顺序: ; (2)a1℃时, 和 的溶解度大小相等; (3)在20 ℃时,将25 g甲固体加入50 g水中,充分搅拌后,仍有9.2 g甲固体未溶解,则20 ℃时甲的溶解度为 ;若将20 ℃下甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法: (任写一种即可)。 12.A~G是初中常见的7种物质,它们的转化关系如下图。 已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧产生有刺激性气味的气体。 (1)写出下列物质的化学符号:B ,D ,G 。 (2)写出下列变化的化学方程式和基本反应类型: ①BF ; ②AB+C 。 (3)E在纯净的B中燃烧,要加少量的水,其目的是 。 13.下图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是空气中含量最多的气体。常温下,丁为黑色固体,戊为紫红色金属;G是一种具有刺激性气味的气体,其水溶液呈碱性,工业上用甲和丙化合制备G;农业上常用F改良酸性土壤(图中部分反应条件已省略)。回答下列问题。 (1)写出下列物质的化学式:D. ,G. 。 (2)工业上用甲和丙化合制备G,反应中甲与丙的分子个数比为 ,在电解A实验中, 极产生物质乙。 (3)H和E反应生成C和戊的化学方程式为 。 (4)工业上可以用甲和四氯化硅在高温条件下发生置换反应来制取硅单质。此反应的化学方程式为 。 14.A、B、C、D是初中化学常见的物质,这四种物质中均含有同一种元素。其中A为无色气体单质,B、C为氧化物,且B为有毒气体,D是大理石的主要成分。它们之间的部分转化关系如下图所示(图中反应条件及部分反应物、生成物已省略)。 回答下列问题。 (1)写出下列物质的化学式:A. ,D. 。 (2)写出由物质C转化为物质B的化学方程式: 。 (3)写出物质C与过氧化钠(Na2O2)反应生成碳酸钠和物质A的化学方程式: 。 15.下图中表示中学几种常见的物质在一定条件下可以转化,A是石灰石的主要成分,E、G为黑色的粉末,C为无色液体,H为紫红色固体。(部分条件已省略) (1)写出下列物质的化学式:A ,C ,D ,E ,F 。 (2)CO2通入D的澄清溶液的化学反应方程式是 。 16.已知铜绿[Cu2(OH)2CO3]在加热时分解生成A、B、C三种常见的氧化物,下面是有关物质之间的转化关系图示。 (1)试通过分析推断,确定下列物质的化学式:H ,X 。 (2)写出F+BG的化学方程式: 。 17.A、B、C、D、E、F是初中化学常见的物质,A、B是含有相同元素的无色液体,D是最轻的气体,F是红色固体单质。根据下图的相互转化关系回答问题。 (1)A物质是 (填化学式)。 (2)写出BD的化学方程式: 。 (3)写出D和E反应的化学方程式: 。 18.下列物质A、B、C、D都是初中化学中的常见物质,它们之间具有如下图所示的转化关系(反应条件、有些反应物或产物已略去)。 其中A与B的组成元素相同,C可使带火星的木条复燃,D是一种无色气体单质。 (1)试写出下列物质的化学式:B ,D 。 (2)写出下列反应的化学方程式:AB: ; DB: 。 19.A~H八种物质之间具有如下图所示的转化关系(反应条件均已略去)。已知:A在空气中缓慢氧化生成的主要物质为B,E为黑色固体,D和F的组成元素相同,一氧化碳可与某些金属氧化物在一定条件下反应得到金属单质。回答下列问题。 (1)写出空气中与A反应的物质的化学式: 。 (2)B物质与稀盐酸反应的现象:固体逐渐减小, 。 (3)写出E+FA+D的化学方程式: 。 参考答案 1.B 2.B 3.D 4.C 5.D 6.B 7.A 8.(1)解:设参加反应的MgSO4的质量为x。 MgSO4+2NaOHMg(OH)2↓+Na2SO4 120 58 x 2.9 g = 解得x=6 g 则20 g溶液中硫酸镁的质量分数:×100%=30% 答:20 g溶液中硫酸镁的质量分数为30%。 (2)≤a 氢氧化钠不足,即使生成氢氧化镁也立即与硫酸反应 9.解:设参加反应的HCl的质量为x。 中和反应为放热反应,由图像可知加入氢氧化钠溶液的质量为20 g时,恰好完全反应。 NaOH+HClNaCl+H2O 40 36.5 20 g×8% x = 解得x=1.46 g 稀盐酸中溶质的质量分数:×100%=14.6% 答:稀盐酸中溶质的质量分数为14.6%。 10.(1)甲>丙>乙 (2)甲 乙 (3)31.6 g 加溶质或恒温蒸发水 12.(1)O2 C SO2 (2)C+O2CO2(化合反应) 2H2O22H2O+O2查看更多