- 2021-06-02 发布 |
- 37.5 KB |
- 16页


文档介绍
化学卷·2018届江西省师大附中高二上学期期中考试化学试卷 (解析版)
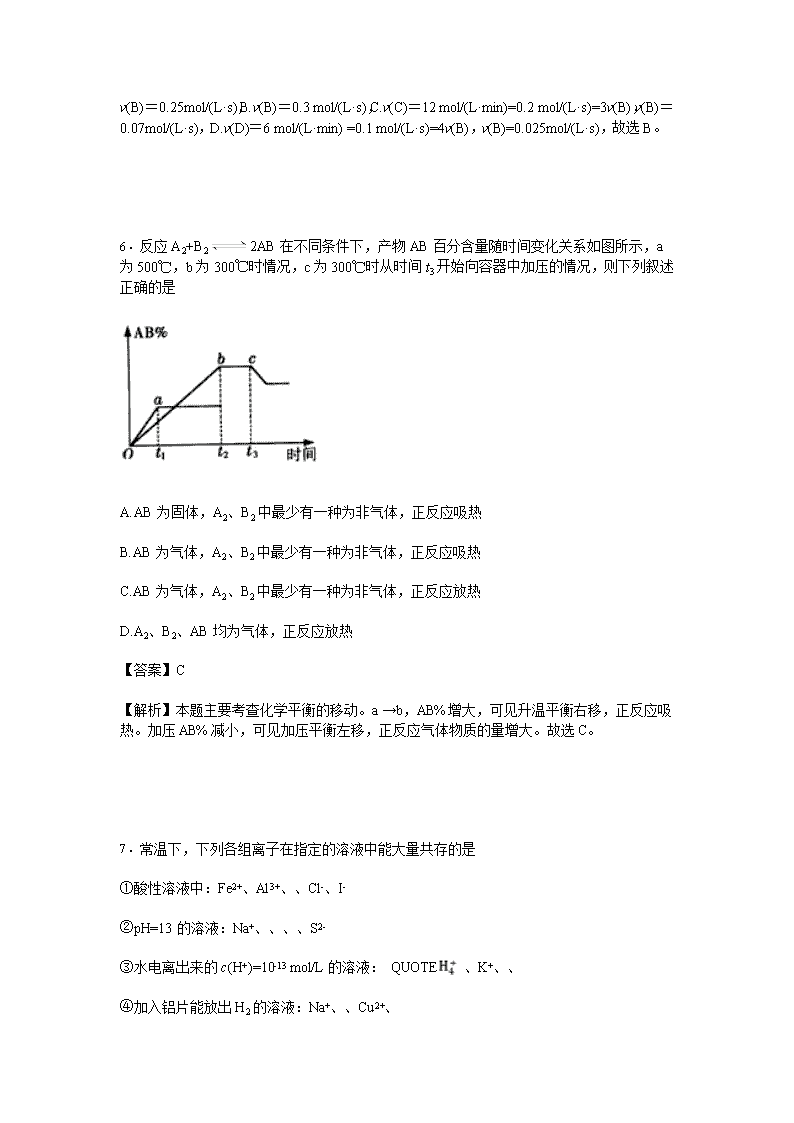
江西省师大附中2016-2017学年高二上学期期中考试化学 一、单选题:共16题 1.在恒温恒压、不做功时,反应A+BC+D在下列哪种情况下,一定能自发进行 A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0 C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0 【答案】C 【解析】本题主要考查反应的自发性。A.低温ΔH-TΔS<0,反应自发进行;高温ΔH-TΔS>0,反应不能自发进行。B.ΔH-TΔS>0,反应不能自发进行;C.ΔH-TΔS<0,反应自发进行。D.高温ΔH-TΔS<0,反应自发进行;低温ΔH-TΔS>0,反应不能自发进行。故选C。 2.下列叙述中不正确的是 A.某特定反应的平衡常数仅是温度的函数 B.化学平衡发生移动,平衡常数必发生变化 C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动 D.催化剂不能改变平衡常数的大小 【答案】B 【解析】本题主要考查平衡常数的特征。A.某特定反应的平衡常数仅是温度的函数,故A正确。B.只要温度一定,即使化学平衡发生移动,平衡常数也不会发生变化,故B不正确。C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动,故C正确。D.催化剂不能引起平衡移动,所以不能改变平衡常数的大小,故D正确。 3.下列物质在水溶液中的电离方程式书写正确的是 A.CH3COOHH++CH3COO- B.NaHSO4Na++H++ C.H3PO43H++ D.NaHCO3Na++H++ 【答案】B 【解析】本题主要考查电离方程式的正误判断。A. CH3COOH 是弱电解质,电离方程式要使用可逆符号,CH3COOHH++CH3COO-,故A错误。B.NaHSO4Na++H++,故B正确。C. H3PO4是三元弱酸,其电离分步进行,H3PO4H++,H++, H++,D. NaHCO3是强电解质,电离方程式要用等号,而且电离出的阴离子是碳酸氢根离子,NaHCO3Na++,故D错误。 4.以NA代表阿伏加德罗常数的值,则关于热化学方程式:C2H2(g)+O2(g)→2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是 A.当10NA个电子转移时,该反应吸收1300 kJ的能量 B.当NA个水分子生成且为液体时,吸收1300 kJ的能量 C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 【答案】D 【解析】本题主要考查反应热的计算。A.当10NA个电子转移时,该反应放出1300 kJ的能量,故A错误。B.当NA个水分子生成且为液体时,放出1300 kJ的能量,故B错误。C. CO2分子中含有4对碳氧共用电子对,当2NA个碳氧共用电子对生成时,放出325 kJ的能量,故C错误。D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量,故D正确。 5.在2A(g)+B(s)3C(g)+4D(g)反应中,表示该反应速率最快的是 A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s) C.v(C)=12 mol/(L·min) D.v(D)=6 mol/(L·min) 【答案】B 【解析】本题主要考查化学反应速率大小的比较。=υ(B)==,将不同物质表示的反应速率转换成用一种物质B表示,并将反应速率单位统一到mol/(L·s)。A.v(A)=0.5mol/(L·s)=2v(B), v(B)=0.25mol/(L·s),B.v(B)=0.3 mol/(L·s),C.v(C)=12 mol/(L·min)=0.2 mol/(L·s)=3v(B),v(B)=0.07mol/(L·s),D.v(D)=6 mol/(L·min) =0.1 mol/(L·s)=4v(B),v(B)=0.025mol/(L·s),故选B。 6.反应A2+B22AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是 A.AB为固体,A2、B2中最少有一种为非气体,正反应吸热 B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热 C.AB为气体,A2、B2中最少有一种为非气体,正反应放热 D.A2、B2、AB均为气体,正反应放热 【答案】C 【解析】本题主要考查化学平衡的移动。a →b,AB%增大,可见升温平衡右移,正反应吸热。加压AB%减小,可见加压平衡左移,正反应气体物质的量增大。故选C。 7.常温下,下列各组离子在指定的溶液中能大量共存的是 ①酸性溶液中:Fe2+、Al3+、、Cl-、I- ②pH=13的溶液:Na+、、、、S2- ③水电离出来的c(H+)=10-13 mol/L的溶液: QUOTE 、K+、、 ④加入铝片能放出H2的溶液:Na+、、Cu2+、 ⑤滴加石蕊试液显红色的溶液:Fe3+、、Cl-、 A.①② B.②③ C.②④⑤ D.②⑤ 【答案】D 【解析】本题主要考查离子共存。①酸性溶液中:H+、与Fe2+发生氧化还原反应,H+、与I-发生氧化还原反应,故不选①;②pH=13的溶液呈碱性,OH-、Na+、、、、S2-不发生反应,故选②;③水电离出来的c(H+)=10-13 mol/L<10-7 mol/L,溶液呈酸性或碱性,碱性溶液中的OH-、发生反应,酸性溶液中的QUOTE H+、发生反应,故不选③;④加入铝片能放出H2的溶液呈酸性或碱性,酸性溶液中的 QUOTE H+、发生反应,碱性溶液中的OH-和Cu2+发生反应,故不选④;⑤滴加石蕊试液显红色的溶液呈酸性,H+、Fe3+、、Cl-、不发生反应,故选⑤。故选D。 8.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g),设起始=Z,在恒压下,平衡时CH4的体积分数(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是 A.该反应的焓变△H﹤0 B.图中Z的大小为b>3>a C.图中X点对应的平衡混合物中=3 D.温度不变时,图中X点对应的平衡在加压后(CH4)减小 【答案】B 【解析】本题主要考查化学平衡的移动。A.升温(CH4)减小,即平衡右移,所以△H>0,故A错误。B.增大H2O的用量,(CH4)减小,所以图中Z的大小为b>3>a,故B正确。C.起始=3,消耗=1:1,所以图中X点对应的平衡混合物中≠3,故C错误。D.温度不变时,加压平衡左移,所以图中X点对应的平衡在加压后(CH4)增大,故D错误。 9.将BaO2放入密闭的真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 A.平衡常数减小 B.BaO量不变 C.气体密度增大 D.氧气压强不变 【答案】D 【解析】本题主要考查化学平衡的移动。A.平衡常数只与温度有关。因为温度不变,所以平衡常数不变,故A错误。B. 加压平衡左移,BaO量减少,故B错误。C. 保持温度不变,平衡常数K不变,而且K=c( O2),所以气体密度不变,故C错误。D.因为c( O2)不变,所以氧气压强不变,故D正确。 10.能证明甲酸是弱酸的实验事实是 A.HCOOH溶液与Zn反应放出H2 B.0.1mol/L HCOOH溶液的pH大于1 C.HCOOH溶液与NaHCO3反应生成CO2 D.0.1 mol/L HCOOH溶液可使紫色石蕊变红 【答案】B 【解析】本题主要考查弱电解质的电离。A.酸溶液都可以与Zn反应放出H2,故不选A。B.若HCOOH为强酸,则0.1mol/L HCOOH溶液的pH等于1,0.1mol/L HCOOH溶液的pH大于1,证明甲酸是弱酸,故选B。C. H2CO3是弱酸,HCOOH溶液与NaHCO3反应生成CO2,只能证明酸性HCOOH>H2CO3,而不能证明HCOOH是强酸,故不选C。D.酸溶液都可使紫色石蕊变红,故不选D。 11.在密闭容器中发生如下反应:mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积扩大到原来的两倍,当达到新平衡时,C的浓度为原来0.6倍,下列说法错误的是 A.m+n1
【答案】C
【解析】本题主要考查弱电解质电离平衡的移动。A.稀释促进弱电解质电离,所以溶液中增大,故A错误。B.增大,醋酸的电离平衡左移,醋酸的电离程度减小,故B错误。C. CH3COOH+ OH-CH3COO-+H2O,溶液中离子浓度增大,溶液的导电性增强,故C正确。D.电荷守恒:+c(OH-)=+,向醋酸中加入氨水至中性即c(OH-)=,所以溶液中=,因此=1,故D错误。
13.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,稀释溶液可能引起由c向d的变化
D.该温度下,加入FeCl3可能引起由b向a的变化
【答案】D
【解析】本题主要考查水的电离平衡的移动。A. c→b,c(H+)增大,c(OH-)减小,而升高温度,c(H+)和c(OH-)均增大,故A错误。B.该温度下,水的离子积常数为(1.0×10-6)2=1.0×10-12,故B错误。C.该温度下,c→d,c(OH-)减小,c(H+)不变,而稀释溶液c(OH-)减小,c(H+)增大,故C错误。D.该温度下, b→a,c(H+)增大,c(OH-)减小,加入FeCl3,c(H+)增大,c(OH-)减小,故D正确。
14.浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随的变化如图所示,下列叙述错误的是
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
【答案】D
【解析】本题考查弱电解质在水溶液中电离平衡,为高频考点,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,易错选项是C,注意:碱无论任何稀释都不能变为中性溶液或酸性溶液,接近中性时要考虑水的电离,为易错点。
A.相同浓度的一元碱,碱的pH越大其碱性越强,根据图知,未加水时,相同浓度条件下,MOH的pH大于ROH的pH,说明MOH的电离程度大于ROH,则MOH的碱性强于ROH的碱性,故A正确;B.由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,故B正确; C.若两种溶液无限稀释,最终其溶液中c(OH-)接近于纯水中c(OH-),所以它们的c(OH-)相等,故C正确; D.根据A知,碱性MOH>ROH,当=2时,由于ROH是弱电解质,升高温度能促进ROH的电离,所以c(M+)/c(R+)减小,D错误;故选D。
15.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2OHClO+H++Cl-K2=10-3.4
HClOH++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
A.Cl2(g)+H2O2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
【答案】C
【解析】本题主要考查电解质溶液知识,意在考查考生对电荷守恒、物料守恒等规律的理解与运用。Cl2(g)+H2O2H++ClO-+Cl- K=K1×K2×Ka,由图可得Ka=1,故K值为1,A项错误;根据电荷守恒得,c(H+)=c(OH-)+c(ClO-)+c(Cl-),而c(HClO)由于部分电离而不等于c(Cl-),B项错误;已知HClO的杀菌能力比ClO-强,从图中可知,c(HClO)在pH=7.5时比在pH=6.5时低,则杀菌效果较差,C项正确;夏季温度高,氯的溶解能力变差,杀菌效果也变差,D项错误。
【备注】【易错辨析】本题中对B项的判断是解题关键,由于Cl2与H2O反应生成等物质的量的HClO和Cl-,再结合电荷守恒所得到的c(H+)=c(OH-)+c(ClO-)+c(Cl-),很容易误判c(HClO)+c(ClO-)=c(H+)-c(OH-)为正确的;所以关键是要了解HClO一定会电离而使其浓度不再与c(Cl-)相等。
16.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.容器②中达平衡时放出热量Q=23.15 kJ
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.平衡时,两个容器中NH3的体积分数相等
【答案】B
【解析】本题主要考查化学平衡的移动。A.某特定反应的平衡常数仅是温度的函数。因此相同温度,容器①、②中反应的平衡常数相等。故A正确。B.容器①、②中达到等效平衡,容器②中达平衡时放出的热量Q<23.15 kJ,故B错误。C.若容器①的体积为0.5 L,减压平衡左移,则平衡时放出热量小于23.15 kJ,故C正确。D.平衡时,容器①、②中达到等效平衡,所以两个容器中NH3的体积分数相等,故D正确。
二、填空题:共5题
17.(1)下列物质中,属于强电解质的是(填序号,下同)__________,属于弱电解质的是________,属于非电解质的是_____________;
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氯化银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
(2)硝酸铅的稀溶液中,滴入几滴稀Na2SO4生成白色PbSO4沉淀,再滴入数滴饱和醋酸钠溶液,微热,并不断搅动,沉淀慢慢溶解;请写出沉淀溶解过程的离子方程式_____________;
(3)已知25℃时,H2C2O4的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;H3PO4的电离平衡常数为K1=7.52×10-3,K2=6.23×10-8,,K3=2.2×10-13。请写出少量H3PO4与过量Na2C2O4反应的离子方程式:_________________________。
【答案】(1)⑤⑥⑦⑨ ;④ ;①⑧;
(2)PbSO4+2CH3COO-Pb(CH3COO)2+
(3) H3PO4++
【解析】本题主要考查弱电解质的电离。
(1)强酸、强碱、大多数盐是强电解质,属于强电解质的是⑤⑥⑦⑨。弱酸、弱碱、水等是弱电解质,属于弱电解质的是④ 。酸碱盐是电解质,酸碱盐以外的化合物一般是非电解质,属于非电解质的是①⑧。
(2)复分解反应的发生条件是生成沉淀或弱电解质或气体。由此判断白色PbSO4沉淀溶解的生成物醋酸铅是弱电解质。沉淀溶解过程的离子方程式为PbSO4+2CH3COO-Pb(CH3COO)2+ 。
(3)酸性H2C2O4>H3PO4>>,少量H3PO4与过量Na2C2O4反应的离子方程式:H3PO4++。
18.某一元弱酸(用HA表示)在水中的电离方程式是:HAH++A-,回答下列问题:
(1)若向溶液中加入少量Na,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液中c(OH-)将________(填“增大”、“减小”或“不变”)。
(2)在一定温度下,HA加水稀释过程中溶液的导电能力如图所示,请回答:
①a、b、c三点溶液中,c(H+)由小到大的顺序是 。
②a、b、c三点溶液中,HA的电离程度最大的是 。
(3)在25℃下,将cmol/L的HA与0.01mol/L的NaOH溶液等体积混合,反应平衡时溶液中c(Na+)=c(A-)。请用含c的代数式表示HA的电离常数Ka=________(注明单位)。
【答案】(1)正 增大 (2)a﹤c﹤b;c (3)mol/L
【解析】本题主要考查弱酸的电离平衡的移动。
(1)若向溶液中加入少量Na,2Na+2H+2Na++H2↑,c(H+)减小,以上平衡将向正反应方向移动,溶液中c(OH-)将增大。
(2)①离子浓度越大,溶液的导电能力越强,a、b、c三点溶液中,导电能力a﹤c﹤b,所以c(H+)由小到大的顺序是a﹤c﹤b。
②稀释有利于弱电解质电离,a、b、c三点溶液中,HA的电离程度最大的是c。 (3)电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),同时c(Na+)=c(A-),所以c(H+)=c(OH-)= 1×10-7mol/L。Ka==mol/L=mol/L。
19.一定温度下,相同体积的四个刚性容器中分别存在以下四个平衡:
①N2(g)+3H2(g)2NH3(g) K1
②H2(g)+I2(g)2HI(g) K2
③2NO2(g)N2O4(g) K3
④C(s)+H2O(g)CO(g)+H2(g) K4
请完成下列各题:
(1)写出反应④的平衡常数的表达式K4=____________;
(2)现有相同温度下的以下平衡:
⑤2N2(g)+6H2(g)4NH3(g) K5
⑥2HI(g)H2(g)+I2(g) K6
则K5= ;K6= ;(用K1、K2、K3、K4表示)
(3)若平衡③中NO2的体积分数为a,某时刻再加入一定量的N2O4,此时v(正) v(逆);再次达到平衡后,NO2的体积分数 a。(填“﹥”、“﹤”或“﹦”)
【答案】(1)K4=
(2)K5=K12;K6=(K2)-1;
(3)﹤;﹤
【解析】本题主要考查平衡常数。(2)①×2=⑤,K5=K12;-②=⑥,K6=(K2)-1;
(3)生成物浓度增大,逆反应速率增大,此时v(正)
- 当前文档收益归属上传用户
- 下载本文档