- 2021-06-02 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习富集在海水中的元素——氯 海水资源利用作业
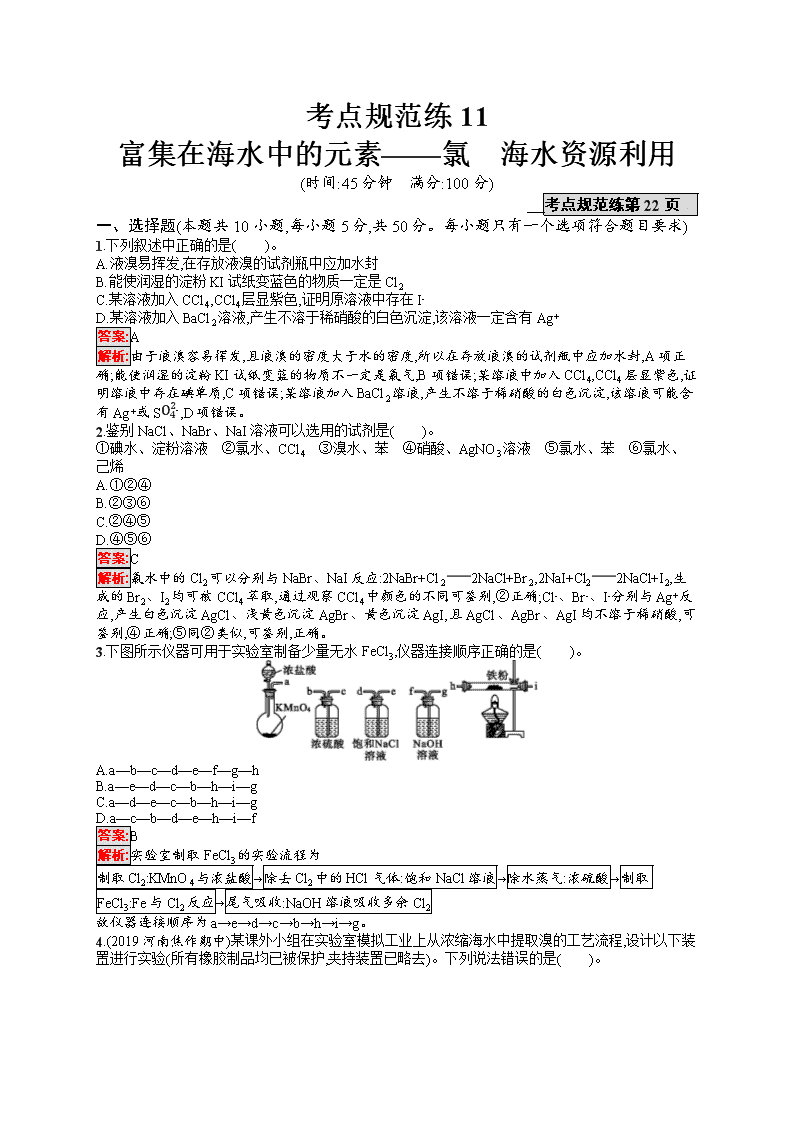
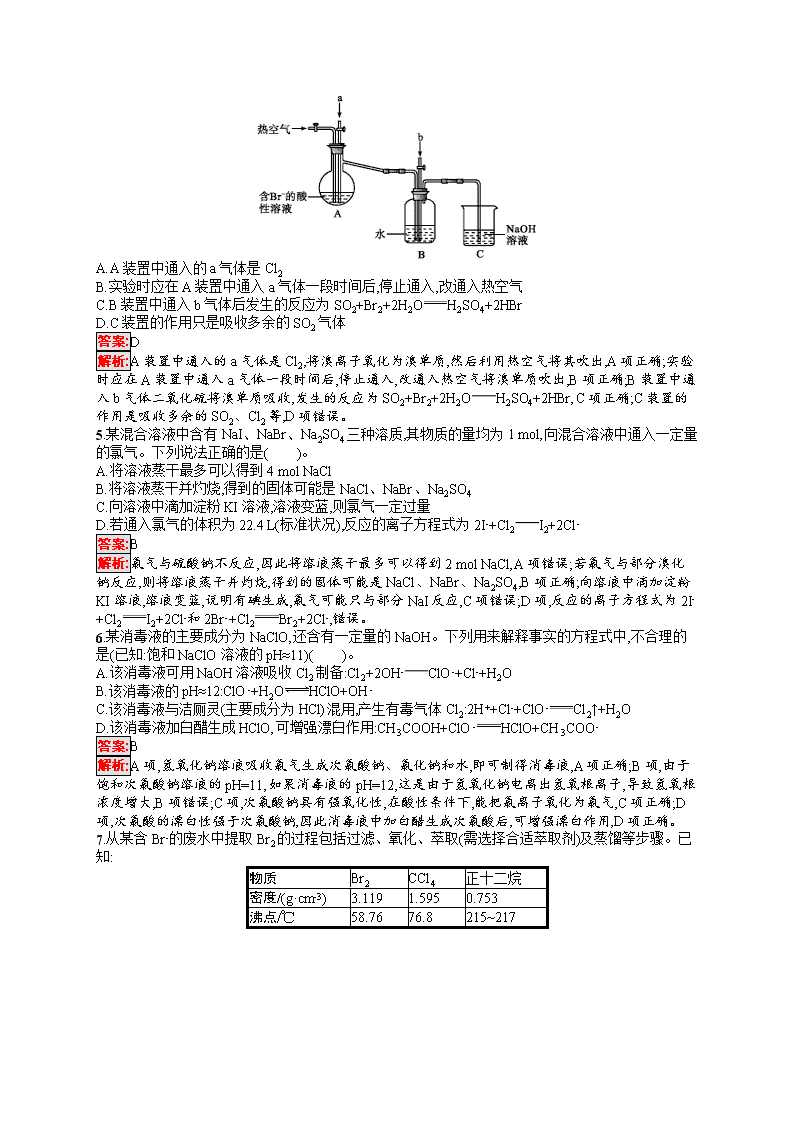
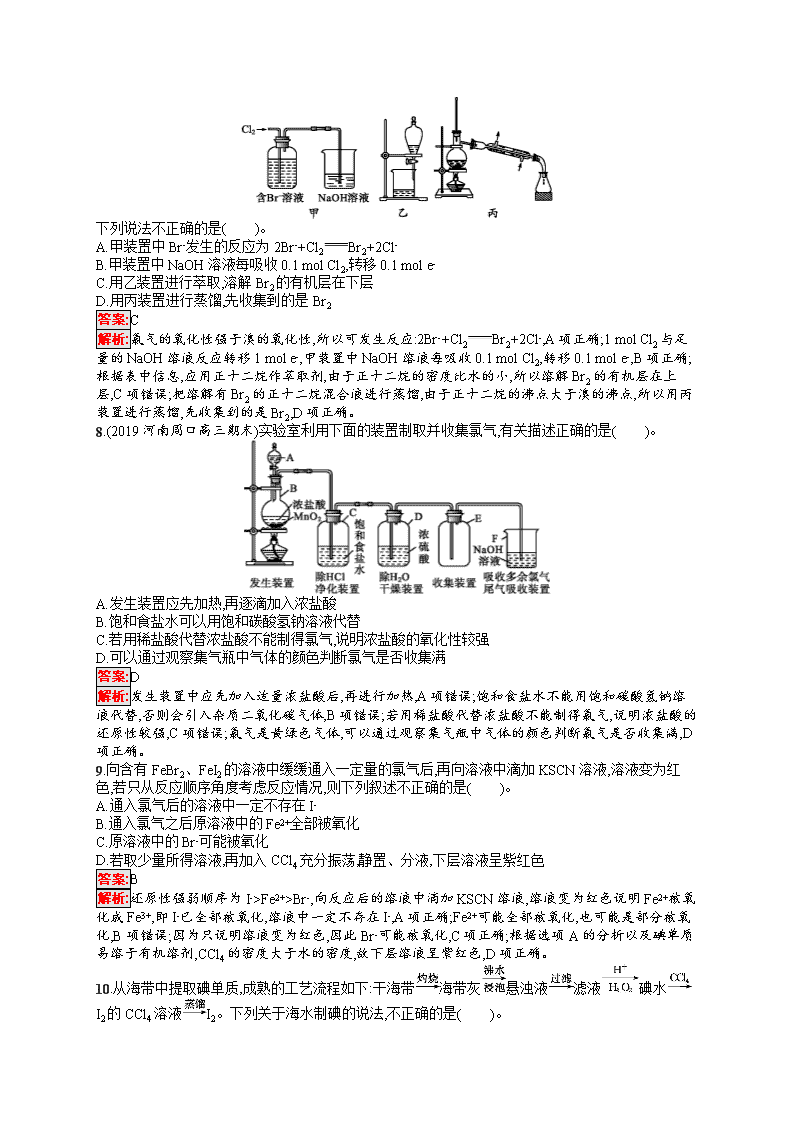
考点规范练11 富集在海水中的元素——氯 海水资源利用 (时间:45分钟 满分:100分) 考点规范练第22页 一、选择题(本题共10小题,每小题5分,共50分。每小题只有一个选项符合题目要求) 1.下列叙述中正确的是( )。 A.液溴易挥发,在存放液溴的试剂瓶中应加水封 B.能使润湿的淀粉KI试纸变蓝色的物质一定是Cl2 C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ 答案:A 解析:由于液溴容易挥发,且液溴的密度大于水的密度,所以在存放液溴的试剂瓶中应加水封,A项正确;能使润湿的淀粉KI试纸变蓝的物质不一定是氯气,B项错误;某溶液中加入CCl4,CCl4层显紫色,证明溶液中存在碘单质,C项错误;某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液可能含有Ag+或SO42-,D项错误。 2.鉴别NaCl、NaBr、NaI溶液可以选用的试剂是( )。 ①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥氯水、己烯 A.①②④ B.②③⑥ C.②④⑤ D.④⑤⑥ 答案:C 解析:氯水中的Cl2可以分别与NaBr、NaI反应:2NaBr+Cl22NaCl+Br2,2NaI+Cl22NaCl+I2,生成的Br2、I2均可被CCl4萃取,通过观察CCl4中颜色的不同可鉴别,②正确;Cl-、Br-、I-分别与Ag+反应,产生白色沉淀AgCl、浅黄色沉淀AgBr、黄色沉淀AgI,且AgCl、AgBr、AgI均不溶于稀硝酸,可鉴别,④正确;⑤同②类似,可鉴别,正确。 3.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )。 A.a—b—c—d—e—f—g—h B.a—e—d—c—b—h—i—g C.a—d—e—c—b—h—i—g D.a—c—b—d—e—h—i—f 答案:B 解析:实验室制取FeCl3的实验流程为 制取Cl2:KMnO4与浓盐酸→除去Cl2中的HCl气体:饱和NaCl溶液→除水蒸气:浓硫酸→制取FeCl3:Fe与Cl2反应→尾气吸收:NaOH溶液吸收多余Cl2 故仪器连接顺序为a→e→d→c→b→h→i→g。 4.(2019河南焦作期中)某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是( )。 A.A装置中通入的a气体是Cl2 B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气 C.B装置中通入b气体后发生的反应为SO2+Br2+2H2OH2SO4+2HBr D.C装置的作用只是吸收多余的SO2气体 答案:D 解析:A装置中通入的a气体是Cl2,将溴离子氧化为溴单质,然后利用热空气将其吹出,A项正确;实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气将溴单质吹出,B项正确;B装置中通入b气体二氧化硫将溴单质吸收,发生的反应为SO2+Br2+2H2OH2SO4+2HBr,C项正确;C装置的作用是吸收多余的SO2、Cl2等,D项错误。 5.某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为1 mol,向混合溶液中通入一定量的氯气。下列说法正确的是( )。 A.将溶液蒸干最多可以得到4 mol NaCl B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4 C.向溶液中滴加淀粉KI溶液,溶液变蓝,则氯气一定过量 D.若通入氯气的体积为22.4 L(标准状况),反应的离子方程式为2I-+Cl2I2+2Cl- 答案:B 解析:氯气与硫酸钠不反应,因此将溶液蒸干最多可以得到2 mol NaCl,A项错误;若氯气与部分溴化钠反应,则将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4,B项正确;向溶液中滴加淀粉KI溶液,溶液变蓝,说明有碘生成,氯气可能只与部分NaI反应,C项错误;D项,反应的离子方程式为2I-+Cl2I2+2Cl-和2Br-+Cl2Br2+2Cl-,错误。 6.某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH≈11)( )。 A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-ClO-+Cl-+H2O B.该消毒液的pH≈12:ClO-+H2OHClO+OH- C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒气体Cl2:2H++Cl-+ClO-Cl2↑+H2O D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-HClO+CH3COO- 答案:B 解析:A项,氢氧化钠溶液吸收氯气生成次氯酸钠、氯化钠和水,即可制得消毒液,A项正确;B项,由于饱和次氯酸钠溶液的pH=11,如果消毒液的pH=12,这是由于氢氧化钠电离出氢氧根离子,导致氢氧根浓度增大,B项错误;C项,次氯酸钠具有强氧化性,在酸性条件下,能把氯离子氧化为氯气,C项正确;D项,次氯酸的漂白性强于次氯酸钠,因此消毒液中加白醋生成次氯酸后,可增强漂白作用,D项正确。 7.从某含Br-的废水中提取Br2的过程包括过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知: 物质 Br2 CCl4 正十二烷 密度/(g·cm-3) 3.119 1.595 0.753 沸点/℃ 58.76 76.8 215~217 下列说法不正确的是( )。 A.甲装置中Br-发生的反应为2Br-+Cl2Br2+2Cl- B.甲装置中NaOH溶液每吸收0.1 mol Cl2,转移0.1 mol e- C.用乙装置进行萃取,溶解Br2的有机层在下层 D.用丙装置进行蒸馏,先收集到的是Br2 答案:C 解析:氯气的氧化性强于溴的氧化性,所以可发生反应:2Br-+Cl2Br2+2Cl-,A项正确;1 mol Cl2与足量的NaOH溶液反应转移1 mol e-,甲装置中NaOH溶液每吸收0.1 mol Cl2,转移0.1 mol e-,B项正确;根据表中信息,应用正十二烷作萃取剂,由于正十二烷的密度比水的小,所以溶解Br2的有机层在上层,C项错误;把溶解有Br2的正十二烷混合液进行蒸馏,由于正十二烷的沸点大于溴的沸点,所以用丙装置进行蒸馏,先收集到的是Br2,D项正确。 8.(2019河南周口高三期末)实验室利用下面的装置制取并收集氯气,有关描述正确的是( )。 A.发生装置应先加热,再逐滴加入浓盐酸 B.饱和食盐水可以用饱和碳酸氢钠溶液代替 C.若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的氧化性较强 D.可以通过观察集气瓶中气体的颜色判断氯气是否收集满 答案:D 解析:发生装置中应先加入适量浓盐酸后,再进行加热,A项错误;饱和食盐水不能用饱和碳酸氢钠溶液代替,否则会引入杂质二氧化碳气体,B项错误;若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的还原性较强,C项错误;氯气是黄绿色气体,可以通过观察集气瓶中气体的颜色判断氯气是否收集满,D项正确。 9.向含有FeBr2、FeI2的溶液中缓缓通入一定量的氯气后,再向溶液中滴加KSCN溶液,溶液变为红色,若只从反应顺序角度考虑反应情况,则下列叙述不正确的是( )。 A.通入氯气后的溶液中一定不存在I- B.通入氯气之后原溶液中的Fe2+全部被氧化 C.原溶液中的Br-可能被氧化 D.若取少量所得溶液,再加入CCl4充分振荡,静置、分液,下层溶液呈紫红色 答案:B 解析:还原性强弱顺序为I->Fe2+>Br-,向反应后的溶液中滴加KSCN溶液,溶液变为红色说明Fe2+被氧化成Fe3+,即I-已全部被氧化,溶液中一定不存在I-,A项正确;Fe2+可能全部被氧化,也可能是部分被氧化,B项错误;因为只说明溶液变为红色,因此Br-可能被氧化,C项正确;根据选项A的分析以及碘单质易溶于有机溶剂,CCl4的密度大于水的密度,故下层溶液呈紫红色,D项正确。 10.从海带中提取碘单质,成熟的工艺流程如下:干海带海带灰悬浊液滤液碘水I2的CCl4溶液I2。下列关于海水制碘的说法,不正确的是( )。 A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 B.含I-的滤液中加入稀硫酸和H2O2溶液后,碘元素发生氧化反应 C.在碘水中加入几滴淀粉溶液,溶液变蓝色 D.碘水中加入CCl4可得到I2的CCl4溶液,该操作为“萃取” 答案:A 解析:灼烧固体应在坩埚中进行,蒸发溶液在蒸发皿中进行,A错误;I-被过氧化氢氧化为碘单质,I-发生氧化反应,B正确;淀粉遇到碘单质变蓝,C正确;碘单质在四氯化碳中的溶解度大于在水中的溶解度,碘水中的I2可以转移到四氯化碳中,此过程为萃取,D正确。 二、非选择题(本题共3小题,共50分) 11.(16分)溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为: ①一定条件下,将Cl2通入浓缩的海水中,生成Br2; ②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等; ③用硫酸酸化步骤②得到的混合物。 完成下列填空: (1)Cl2氧化Br-应在 (填“酸性”或“碱性”)条件下进行,目的是避免 。 (2)Br2可用热空气吹出,其原因是 。 (3)写出步骤③中发生反应的化学方程式 。 用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为 。 (4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。 a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液 答案:(1)酸性 Cl2发生歧化反应生成HClO和HCl (2)Br2易挥发 (3)3H2SO4+5NaBr+NaBrO33Na2SO4+3Br2+3H2O 溴酸能将氯离子氧化成氯气 酸化后能生成溴,溴具有强氧化性(或易挥发、强腐蚀性) (4)ac 解析:(1)Cl2和Br2都能与NaOH溶液反应生成盐和水,故氯气氧化Br-应在酸性条件下进行。 (2)溴具有极强的挥发性,利用热空气就能将海水中的溴带出。 (3)在酸性条件下,NaBrO3将NaBr氧化为Br2;NaBrO3具有强氧化性,盐酸具有还原性,用盐酸酸化会使得制备的溴中含有氯气;溴具有强腐蚀性和挥发性,而NaBr和NaBrO3稳定性强。 (4)HBr、NaBr都能与Cl2反应生成Br2,但加入NaBr溶液后会引入杂质水;Cl2和Br2都能被Na2CO3吸收,都能被Na2SO3还原。 12.(16分)次氯酸是一种不稳定的强氧化性酸,只能存在于溶液中。某同学利用下列仪器制得了较高浓度的次氯酸溶液,同时证明了氯气没有漂白性。 (1)实验中仪器的连接顺序为A ,F中布条是 (填“干布条”或“湿布条”),试剂b是 。 (2)C中使用浓硫酸的目的是 ,A中发生反应的离子方程式为 。 (3)可观察到F中产生的现象是 ,试剂a最好是 (填“CaCO3”或 “NaOH”)。 (4)如何证明HClO有强氧化性? (要求写出主要操作过程、现象与结论)。 答案:(1)EBFCD 干布条 NaOH溶液 (2)防止F后面装置里的水蒸气进入F,使干布条变湿 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O (3)红布条不褪色,同时充满黄绿色气体 CaCO3 (4)取少量反应后的C中的溶液加入试管中,向其中滴加适量的淀粉KI溶液,试管内溶液变蓝色(或其他合理答案) 解析:(1)从A中导出的氯气中含有H2O(g)、HCl,为排除HCl的干扰,先使气体通过E除去HCl,再用装置B除去H2O(g),然后将干燥的氯气通入放有干燥红布条的F中,故仪器的连接顺序为AEBFCD。装置D是吸收尾气的,故试剂b是NaOH溶液。(2)C中使用浓硫酸的目的是防止F后面装置中的水蒸气进入F,使干布条变湿。(3)F中红布条不褪色,同时F中充满黄绿色气体。由向漂白粉溶液中通入CO2气体能产生CaCO3沉淀和HClO知,HClO不与CaCO3反应;Cl2溶于水发生反应:Cl2+H2OHCl+HClO,HCl可与CaCO3反应,促使平衡正向移动,故选CaCO3。(4)由于CaCO3足量,故可认为反应后C中溶液的溶质是CaCl2、HClO,CaCl2一般情况下难以表现出氧化性,取反应后的C中溶液加入试管中,再向其中滴加淀粉KI溶液,根据溶液颜色的变化可以证明HClO有强氧化性。 13.(18分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。 图1 图2 (1)仪器D的名称是 。安装F中导管时,应选用图2中的 。 (2)打开B的活塞,A中发生反应:2NaClO3+4HCl2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。 (3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。 (4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。 (5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。 图3 答案:(1)锥形瓶 b (2)慢 (3)吸收Cl2 (4)4H++5ClO2-Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 (5)稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度 解析:(1)仪器D为锥形瓶;将气体通入淀粉KI溶液中,导管需要“长进短出”,“短进长出”会导致溶液被排出,故选用b装置。 (2)为使ClO2被D中稳定剂充分吸收,缓慢滴加盐酸,如果产生ClO2速率过快,则吸收效率较低。 (3)F中淀粉KI溶液颜色不变,说明没有Cl2进入F中,则装置C的作用是吸收氯气。 (4)根据题中给出的反应物和生成物,可以写出离子方程式:4H++5ClO2-Cl-+4ClO2↑+2H2O。若在D中ClO2被稳定剂吸收则有NaClO2生成,滴入盐酸则重新生成ClO2;会进入F溶液中使其变色,故装置F的作用是验证是否有ClO2生成。 (5)稳定剂Ⅱ加酸后释放ClO2的速率比较平稳且时间较长,能够长时间保持所需浓度。查看更多