- 2021-06-01 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省大连市旅顺口区2018-2019学年高二上学期期末考试化学试卷
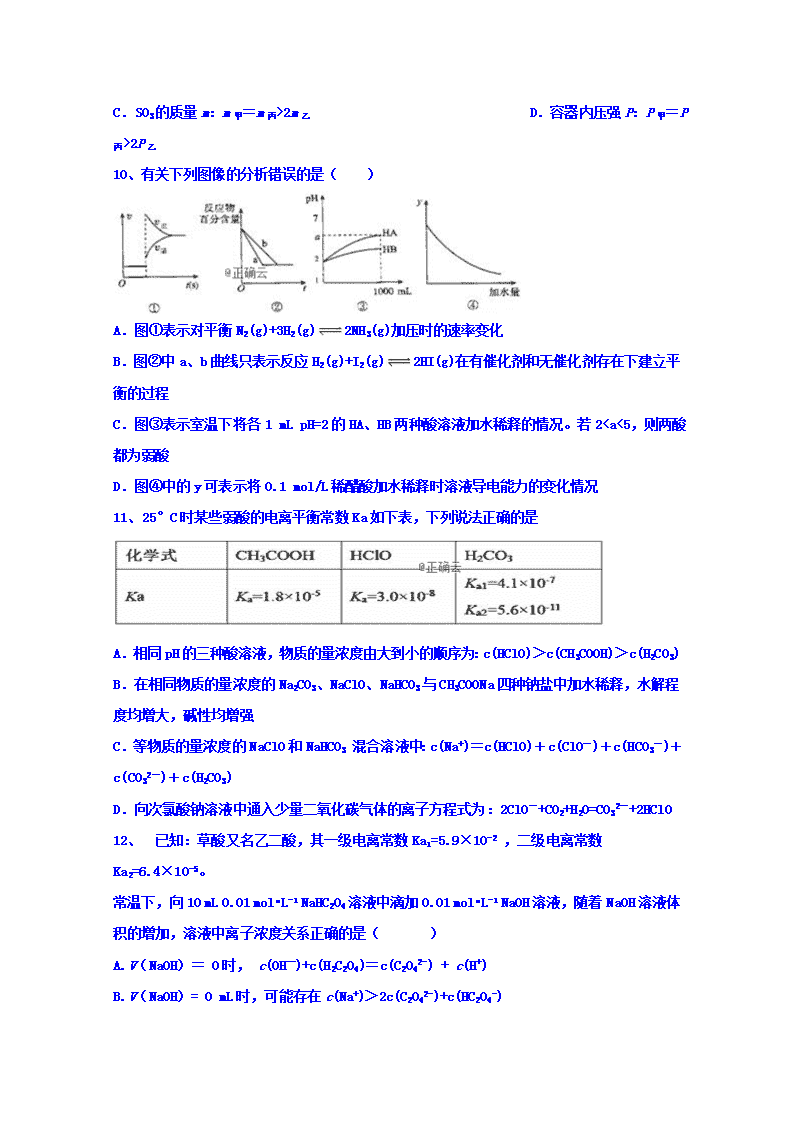
期末考试 高二化学试卷 (本考试90分钟,满分100分) 可能用到的相对原子质量:N 14 O 16 Ag 108 S 32 Cl 35.5 Cu 64 C 12 Na 23 可能用到的数据: lg2=0.3 lg3=0.5 lg5=0.7 第I卷 选择题 一、单项选择题(本题20小题,每题3分,共计60分) 1、下列离子方程式中,属于水解反应的是 A.HCOOH+H2OHCOO- + H3O+ B.CO2+H2OHCO3- + H+ C.CO32- + H2OHCO3- + OH- D.HS-S2- + H+ 2、勒夏特列原理由法国化学家勒夏特列于1888年发现。勒夏特列还发明了热电偶和光学高温计,高温计可顺利地测定3000℃以上的高温。他还发明了乙炔氧焰发生器,迄今还用于金属的切割和焊接。下列事实不能用勒夏特列原理解释的是( ) ①溴水中存在化学平衡:Br2+H2OHBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 ②铁在潮湿的空气中易生锈 ③二氧化氮与四氧化二氮的平衡体系,压缩体积后颜色加深 ④工业合成氨反应(放热)为加快反应速率,将温度升高到500℃左右 ⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)K(g)+NaCl(l) A.①④⑤ B.①②③ C.②③④ D.②④ 3、下列说法正确的是( ) A.难溶电解质的溶度积Ksp越小,则它的溶解度越小 B.任何难溶物在水中都可以存在沉淀溶解平衡,给定温度的溶解度大小都可以用Ksp计算出来 C.溶度积常数Ksp与温度有关,温度越高,溶度积越大 D.向饱和碘化银溶液中滴加某氯化钠溶液,沉淀由黄色逐渐变为白色,说明Ksp(AgCl)< Ksp(AgI) 4、下列说法正确的是( ) ①.AlCl3溶液和Al2(SO4)3溶液加热蒸干,所得固体的成分相同 ②.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 ③.氟化铵溶液不能用玻璃瓶盛装 ④.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 ⑤.明矾可以做净水剂 ⑥.向碳酸钙中加入氯化铁溶液会产生气体,并能产生红褐色沉淀 A.②③④⑤ B.③⑤⑥ C.①②③④⑤ D.①②④⑥ 5、化学中有很多有趣的现象和规律,它可以借助于数学工具来描述。符合下表分子式的分子本身或其某种同分异构体,仅有一种一氯代物,请判断第7项的分子式( ) 1 2 3 4 5 6 7 8 CH4 C2H6 C5H12 C8H18 A.C13H28 B.C17H36 C. C26H54 D.C53H108 6、某温度下,水的电离平衡常数K电离=1.8×10-15,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合(不考虑体积变化),所得混合溶液的pH=10,则强碱与强酸的体积比约为( ) A.5.6﹕1 B.9﹕1 C.1﹕5.6 D.1﹕9 7、下列各种情况下一定能大量共存的离子组为( ) A. Fe3+、Cl-、Na+、SCN- B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Al3+、CO32--、Cl-、K+ C.能使甲基橙试剂变黄的溶液:Na+、Cl-、K+、S2O32-- D.Mg2+、SO42--、I-、Na+ 8、在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.7倍.下列叙述中不正确 A.平衡向逆反应方向移动 B.a<c+d C.z的体积分数增加 D.X的转化率下降 9、已知2SO2(g)+O2(g)⇌2SO3(g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙)1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是 A.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 B.c(SO2)与c(O2)之比k:k甲=k丙>k乙 C.SO3的质量m:m甲=m丙>2m乙 D.容器内压强P:P甲=P丙>2P乙 10、有关下列图像的分析错误的是( ) A.图①表示对平衡N2(g)+3H2(g)2NH3(g)加压时的速率变化 B.图②中a、b曲线只表示反应H2(g)+I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 C.图③表示室温下将各1 mL pH=2的HA、HB两种酸溶液加水稀释的情况。若2查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档