- 2021-06-01 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课时知能训练7
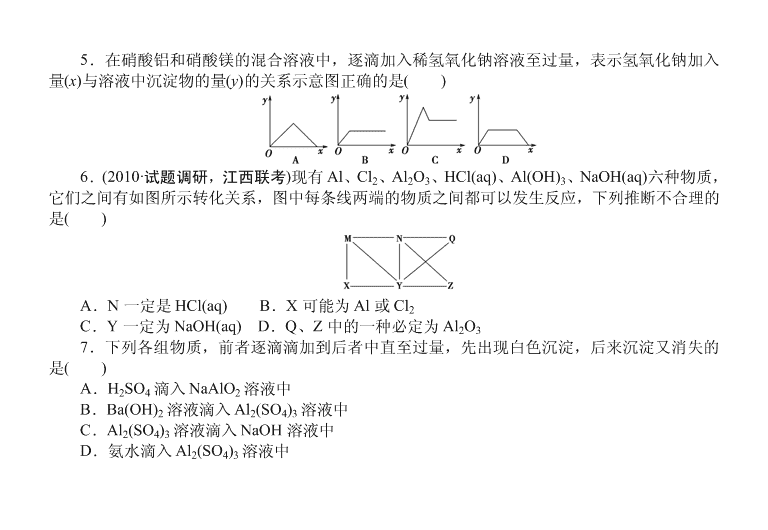
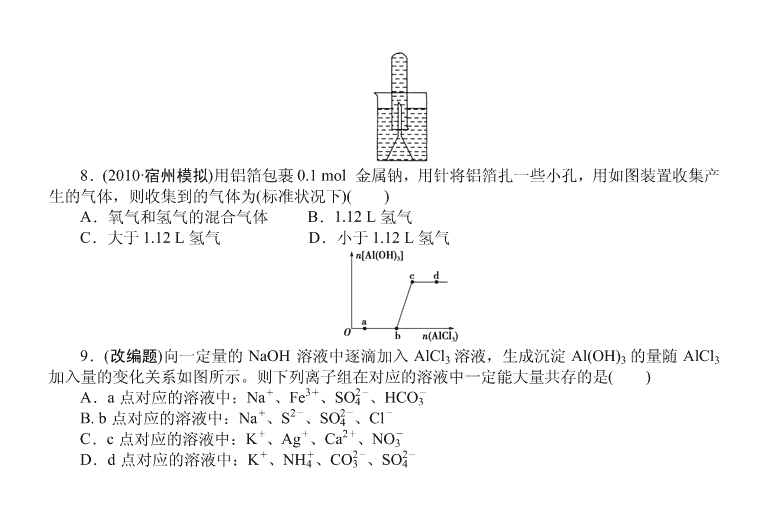
一、选择题 1.(原创题)将铝条插入 NaOH 溶液中,开始没有 H2 生成的原因是( ) A.铝与 NaOH 溶液不反应 B.铝条表面钝化生成 Al2O3 C.铝条不纯含有杂质 Mg D.NaOH 溶液中含有 NaAlO2 2.(改编题)下列除去杂质的方法不正确的是( ) A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 B.用过量氨水除去 Fe3+溶液中的少量 Al3+ C.Al(OH)3 中混有少量 Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量 CO2 后过滤 D.MgO 中混有少量 Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到 MgO 3.(2010·山东高考,改编)铝材经脱脂后进行碱洗以除去氧化膜,将碱洗后的溶液中的铝以沉 淀形式回收,最好加入下列试剂( ) A.氨水 B.CO2 C.NaOH D.HNO3 4.(原创题)下列离子方程式不正确的是( ) A.铝片碱洗时常有气泡:2Al+2OH-+2H2O===2AlO- 2 +3H2↑ B.Al2O3 溶于氨水溶液:Al2O3+2OH-===AlO- 2 +H2O C.AlCl3 溶液中加入过量 NaOH 溶液:Al3++4OH-===AlO- 2 +2H2O D.实验室用铝盐制 Al(OH)3:Al3++3NH3 ·H 2O===Al(OH)3↓+3NH+ 4 5.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液至过量,表示氢氧化钠加入 量(x)与溶液中沉淀物的量(y)的关系示意图正确的是( ) 6.(2010·试题调研,江西联考)现有 Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质, 它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的 是( ) A.N 一定是 HCl(aq) B.X 可能为 Al 或 Cl2 C.Y 一定为 NaOH(aq) D.Q、Z 中的一种必定为 Al2O3 7.下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的 是( ) A.H2SO4 滴入 NaAlO2 溶液中 B.Ba(OH)2 溶液滴入 Al2(SO4)3 溶液中 C.Al2(SO4)3 溶液滴入 NaOH 溶液中 D.氨水滴入 Al2(SO4)3 溶液中 8.(2010·宿州模拟)用铝箔包裹 0.1 mol 金属钠,用针将铝箔扎一些小孔,用如图装置收集产 生的气体,则收集到的气体为(标准状况下)( ) A.氧气和氢气的混合气体 B.1.12 L 氢气 C.大于 1.12 L 氢气 D.小于 1.12 L 氢气 9.(改编题)向一定量的 NaOH 溶液中逐滴加入 AlCl3 溶液,生成沉淀 Al(OH)3 的量随 AlCl3 加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( ) A.a 点对应的溶液中:Na+、Fe3+、SO2- 4 、HCO- 3 B. b 点对应的溶液中:Na+、S2-、SO2- 4 、Cl- C.c 点对应的溶液中:K+、Ag+、Ca2+、NO- 3 D.d 点对应的溶液中:K+、NH+ 4 、CO2- 3 、SO2- 4 10.(2010·淄博模拟改造)美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝 化合物的推测不正确的是( ) A.氢铝化合物与水反应生成氢氧化铝和氢气 B.与 H2O 反应生成 2.24 L H2(标况下),转移的电子为 0.2 mol C.氢铝化合物中氢显-1 价 D.氢铝化合物具有强还原性 二、非选择题 11.(2010·济南模拟)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从 铝土矿中制备铝的工艺流程: 已知: (1)铝土矿的主要成分是 Al2O3,此外还含有少量 SiO2、Fe2O3 等杂质; (2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+ 2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH 回答下列问题: (1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式:______。 (2)滤渣 A 的主要成分为________;滤渣 A 的用途是________(只写一种);实验室过滤时使用 玻璃棒,其作用是________________。 (3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是__________________。 (4)若将铝溶解,下列试剂中最好选用________(填编号)。 A.浓硫酸 B.稀硫酸 C.稀硝酸 理由是______________________________________________________________。 12.(2010·长郡中学模拟改编)据下列信息完成所需回答的问题: 其中氧化物 A 是白色固体,氧化物 B 是黑色粉末,单质 C 不溶于冷、浓硝酸。 (1)写出下列物质的化学式:A________、D________、M________。 (2)写出下列反应的离子方程式 ①B→D:__________________________;②C→N:__________________________; ③G→N:__________________________。 (3)单质 C 不溶于冷的浓 HNO3 的理由是___________ 13.(2010·北京高考)由短周期元素组成的化合物 X 是某抗酸药的有效成分。甲同学欲探究 X 的组成。 查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸 镁铝、磷酸铝、碱式碳酸镁铝。②Al3+在 pH=5.0 时沉淀完全;Mg2+在 pH=8.8 时开始沉淀, 在 pH=11.4 时沉淀完全。 实验过程: Ⅰ.向化合物 X 粉末中加入过量盐酸,产生气体 A,得到无色溶液。 Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰。 Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节 pH 至 5~6,产生白色沉淀 B,过滤。 Ⅳ.向沉淀 B 中加过量的 NaOH 溶液,沉淀全部溶解。 Ⅴ.向Ⅲ中得到的滤液中滴加 NaOH 溶液,调节 pH 至 12,得到白色沉淀 C。 (1)Ⅰ中气体 A 可使澄清石灰水变浑浊,A 的化学式是________。 (2)由Ⅰ、Ⅱ判断 X 一定不含有的元素是磷、________。 (3)Ⅲ中生成 B 的离子方程式是_______________________________________________。 (4)Ⅳ中 B 溶解的离子方程式是_________________________________________________。 (5)沉淀 C 的化学式是________。 (6)若上述 n(A)∶n(B)∶n(C)=1∶1∶3,则 X 的化学式是________。 14.将 0.1 mol 的镁和铝的混合物溶于 100 mL 2 mol/L H2SO4 溶液中, 然后再滴加 1 mol/L 的 NaOH 溶液。请回答下列问题: (1)若在滴加 NaOH 溶液的过程中,沉淀质量 m 随加入 NaOH 溶液的体 积 V 的变化如图所示。 当 V1=160 mL 时,则金属粉末中 n(Mg)=________ mol,V2=________ mL。 (2)若在滴加 NaOH 溶液的过程中,欲使 Mg2+、Al3+刚好沉淀完全,则滴入 NaOH 溶液的体 积 V(NaOH)=________ mL。 答案及解析 1.【解析】 本题主要考查铝的钝化,铝条在空气中钝化形成 Al2O3 薄膜,开始时 Al2O3 与 NaOH 反应,没有 H2 生成。【答案】 B 2.【解析】 本题主要考查铝及其化合物的主要性质。A、C、D 均是利用 Al、Al(OH)3、Al2O3 与烧碱反应的原理进行除杂,A、C、D 均正确;B 项用氨水均生成 Fe(OH)3 和 Al(OH)3,因 Al(OH)3 不溶于过量氨水。【答案】 B 3.【解析】 本题主要考查 Al2O3 的性质和 AlO- 2 的沉淀试剂。碱洗液中 Al 主要以 AlO- 2 形式 存在,最好加入弱酸(CO2+H2O),加入 CO2 最好。【答案】 B 4.【解析】 本题主要考查 Al 及其重要化合物的离子反应。B 项中 Al2O3 不溶于氨水。 【答案】 B 5.【解析】 本题考查 Al(OH)3 沉淀的图象问题。Al(OH)3 生成后随 NaOH 的加入又溶解减 少至消失。【答案】 C 6.【解析】 六种物质中,Al 与 3 种物质反应,Cl2 与 2 种物质反应,Al2O3 与 2 种物质反应, HCl(aq)与 4 种物质反应,Al(OH)3 与 2 种物质反应,NaOH(aq)与 5 种物质反应。【答案】 B 7.【解析】 本题主要考查 Al(OH)3 的两性。B 项生成 BaSO4,沉淀不会消失;C 项开始 NaOH 过量,生成的沉淀立即溶解,后来出现沉淀;D 项生成的 Al(OH)3 沉淀不溶解。【答案】 A 8.【解析】 0.1 mol 的 Na 能产生 1.12 L H2(标况),又因为铝箔中的 Al 又与 NaOH 溶液反 应生成 H2,所以收集到的气体大于 1.12 L H2。【答案】 C 9.【解析】 向 NaOH 溶液中逐渐加入 AlCl3 溶液时发生 Al3++4OH-===AlO- 2 +2H2O,3AlO- 2 +Al3++6H2O===4Al(OH)3↓。a 点时溶液中有大量 OH-,与 Fe3+、HCO- 3 不能大量共存。b 点时 溶质为 NaCl 和 NaAlO2,所有离子可以大量共存。c 点时溶质为 NaCl,与 Ag+不能大量共存。d 点时溶质为 NaCl 和 AlCl3,Al3+与 CO2- 3 互相促进水解不能大量共存。【答案】 B 10.【解析】 本题是一道创新题。由化合物中元素正负化合价代数和为零,并结合 H、Al 原子结构特点可知氢铝化合物中 Al 为+3 价、H 为-1 价;该化合物中 H 元素处于最低价态,具 有强还原性,可与水发生氧化还原反应生成氢气,同时生成氢氧化铝,生成 2.24 L H2 即 0.1 mol , 转移电子也为 0.1 mol。【答案】 B 11.【解析】 (1)Al2O3 属于两性氧化物,SiO2 属于酸性氧化物,都能与强碱反应。 (2)利用题目给出的信息——“硅铝酸盐沉淀”,可以知道滤渣 A 的主要成分是 Fe2O3、 Na2Al2Si2O8。对于滤渣 A 的用途一般很容易想到其可以作为炼铁的原料。 (3)因为 Al(OH)3 是两性氢氧化物,若用强酸酸化滤液时,无法保证将全部铝元素转化为 Al(OH)3 过滤出来。 (4)分析问题时,一般要同时考虑生产效益(原料利用率)和环保问题。 【答案】 (1)Al2O3+2OH-===2AlO- 2 +H2O、SiO2+2OH-===SiO2- 3 +H2O (2)Fe2O3、Na2Al2Si2O8 炼铁的原料(或生产硅酸盐产品的原料) 引流 (3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以 NaAlO2 的形式存在于滤液中,通入过 量二氧化碳可以将 NaAlO2 完全转化为 Al(OH)3 (4)B 铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体 SO2,原料利用率低;稀硝 酸能溶解铝但会产生 NO 气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的 H2 对空气无污染 12.【解析】 本题主要考查铝及其化合物的性质和推断。 由 A 电解得 C,可确定 A 为 Al2O3,C 为 Al;由黑色氧化物 B 与浓盐酸反应生成单质 D,可 确定 B 为 MnO2,D 为 Cl2,进而可确定 M 为 AlCl3,G 为 Al(OH)3,N 为 NaAlO2。 【答案】 (1)Al2O3 Cl2 AlCl3 (2)①MnO2+2Cl-+4H+△,Mn2++Cl2↑+2H2O②2Al+2OH-+2H2O===2AlO- 2 +3H2↑ ③Al(OH)3+OH-===AlO- 2 +2H2O (3)Al 遇浓 HNO3 在常温下钝化形成氧化膜 13.【解析】 由Ⅰ产生气体为 CO2,X 中含 CO2- 3 或 HCO- 3 得到无色溶液 X 中不含 SiO2- 3 ; 由Ⅱ,X 中不含 Na+,即不含 NaHCO3;由Ⅲ、Ⅳ结合资料②知,X 中含 Al3+,由Ⅳ知,X 中含 Mg2+。 【答案】 (1)CO2 (2)钠、硅 (3)Al3++3NH3·H 2O===Al(OH)3↓+3NH+ 4 (4)Al(OH)3+OH-===AlO- 2 +2H2O (5)Mg(OH)2 (6)Mg3Al(OH)7CO3 14.【解析】 (1)由图象可知:160 mL 的 NaOH 溶液是与过量的 H2SO4 溶液反应的,则与 Mg、Al 反应的 n(H2SO4)=0.2 mol-0.16 mol×1 2=0.12 mol。假设 n(Mg)=x mol,n(Al)=y mol, 则有方程组: x+y=0.1 x+3 2y=0.12 ,解得 x=0.06,y=0.04。当加入 V2 mL NaOH 溶液时,得到 Mg(OH)2 沉淀和 NaAlO2 , 关 系 式 为 : Mg2 + ~ 2OH - , Al3 + ~ 4OH - ,则 V2 = 160 mL + 0.06×2 mol+0.04×4 mol 1 mol/L ×103 mL/L=440 mL。(2)当 Mg2+、Al3+刚好沉淀完全时,溶液中只有 Na2SO4,关系式为 2NaOH~H2SO4,则 V(NaOH)=100 mL×2 mol/L×2 1 mol/L =400 mL。 【答案】 (1)0.06 440 (2)400查看更多