陕西省榆林市绥德县绥德中学2019-2020高二下学期第一次阶段性测试化学试卷
化 学 试 题(卷)
第Ⅰ卷(选择题,共48分)
可能用到的相对原子质量:H—1 C—12 O—16 N—14 Na—23 Cl—35.5 Mg—24 Zn—65 S—32 Cu—64 Pb—207
一、选择题(本小题包括16小题,每小题只有一个选项符合题意,每小题3分,共48分)
1. 生产生活中的下列做法正确的是 ( )
A.用明矾做自来水的消毒剂
B.废弃的干电池不能随意丢弃,但可以土埋处理
C.用电解NaCl溶液来制备金属钠
D.电工操作中,不能把铜线和铝线拧在一起连接线路
2. 下列说法正确的是 ( )
A.常温下,0.1mol·L-1盐酸pH大于0.1mol·L-1 醋酸的pH
B.升高温度使反应速率加快,是因为降低了反应的活化能
C.使用催化剂可以改变反应的平衡常数
D.光伏电池可实现太阳能到电能的转化
3. 下列有关热化学反应的描述正确的是 ( )
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO的燃烧热ΔH=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) ΔH=(2×283.0)kJ/mol
C. 已知:C(s)+O2(g)=CO2(g)H1 ;C(s)+O2(g)=CO(g)H2 ,则H1>H2
D. C(石墨,s)= C(金刚石,s) ΔH=+1.9kJ·mol-1 ,则金刚石比石墨稳定
4. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g),H= kJ/mol(>0)。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是 ( )
A.若2(NH3)=(CO2),则该反应达到平衡状态
B.两次平衡后,后一次平衡CO2的浓度大
C.重新达到平衡,密闭容器中氨气的体积分数不变
D.若开始时向容器中加入2 mol NH3和1 mol CO2,则达平衡时放出 kJ热量
5. 下列事实不能用勒夏特列原理解释的是 ( )
A.对于2HI(g)⇌H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
B.合成氨反应中为提高氨产率,理论上应采取降低温度的措施
C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释
D.用饱和食盐水可以去除Cl2中的HCl
6. 一定条件下,将2 molA、1 molB放在体积为2L的密闭容器中反应:3A(g)+B(g)⇌xC(g)+2D
(g),2 min达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是 ( )
A.x=1
B.2min内A的反应速率为0.2 mol·L-1·min-1
C.B的转化率为40%
D.达平衡状态时,2v正(B)=v逆(D)
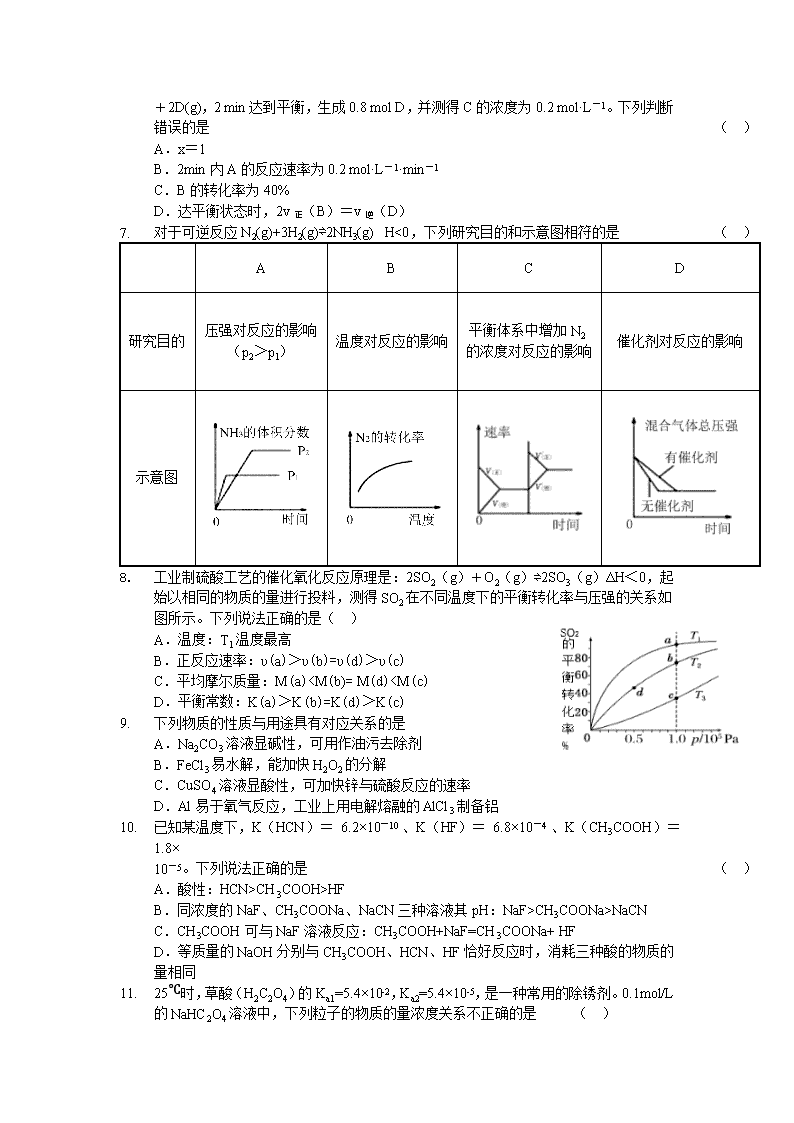
1. 对于可逆反应N2(g)+3H2(g)⇌2NH3(g) H<0,下列研究目的和示意图相符的是 ( )
A
B
C
D
研究目的
压强对反应的影响
(p2>p1)
温度对反应的影响
平衡体系中增加N2的浓度对反应的影响
催化剂对反应的影响
示意图
2. 工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)⇌2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
A.温度:T1温度最高
B.正反应速率:υ(a)>υ(b)=υ(d)>υ(c)
C.平均摩尔质量:M(a)
CH3COOH>HF
B.同浓度的NaF、CH3COONa、NaCN三种溶液其pH:NaF>CH3COONa>NaCN
C.CH3COOH可与NaF溶液反应:CH3COOH+NaF=CH3COONa+ HF
D.等质量的NaOH分别与CH3COOH、HCN、HF恰好反应时,消耗三种酸的物质的量相同
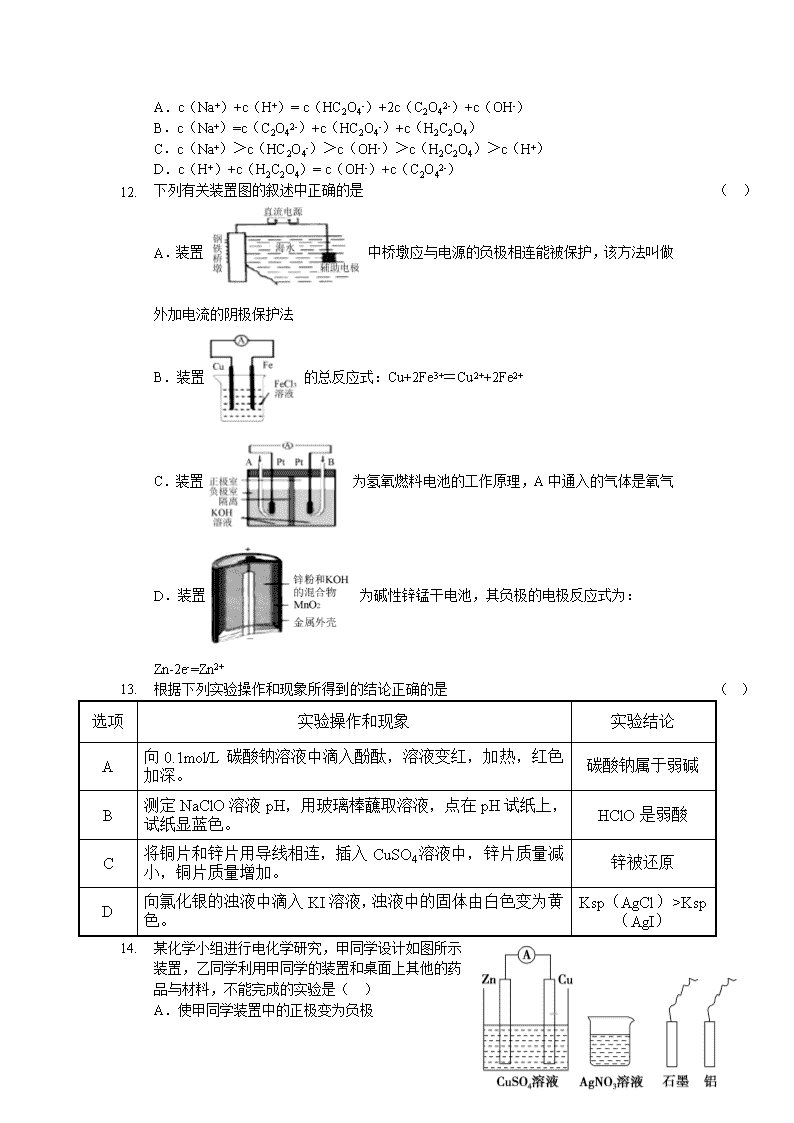
5. 25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是 ( )
A.c(
Na+)+c(H+)= c(HC2O4-)+2c(C2O42-)+c(OH-)
B.c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
C.c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+)
D.c(H+)+c(H2C2O4)= c(OH-)+c(C2O42-)
1. 下列有关装置图的叙述中正确的是 ( )
A.装置中桥墩应与电源的负极相连能被保护,该方法叫做外加电流的阴极保护法
B.装置的总反应式:Cu+2Fe3+=Cu2++2Fe2+
C.装置为氢氧燃料电池的工作原理,A中通入的气体是氧气
D.装置为碱性锌锰干电池,其负极的电极反应式为:Zn-2e-=Zn2+
2. 根据下列实验操作和现象所得到的结论正确的是 ( )
选项
实验操作和现象
实验结论
A
向0.1mol/L碳酸钠溶液中滴入酚酞,溶液变红,加热,红色加深。
碳酸钠属于弱碱
B
测定NaClO溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显蓝色。
HClO是弱酸
C
将铜片和锌片用导线相连,插入CuSO4溶液中,锌片质量减小,铜片质量增加。
锌被还原
D
向氯化银的浊液中滴入KI溶液,浊液中的固体由白色变为黄色。
Ksp(AgCl)>Ksp(AgI)
3. 某化学小组进行电化学研究,甲同学设计如图所示装置,乙同学利用甲同学的装置和桌面上其他的药品与材料,不能完成的实验是( )
A.使甲同学装置中的正极变为负极
B.
设计一个新的原电池
C.在石墨电极上镀锌
D.使锌电极受到保护
1. 已知:HCN(aq)与NaOH(aq)反应的H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的H =-55.6 kJ/mol,则HCN在水溶液中电离的H等于 ( )
A.-67.7kJ/mol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7 kJ/mol
2. 1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是 ( )
A.XOH是弱碱
B.pH=10的溶液中c(X+):XOH大于X2CO3
C.CO32-的水解常数Kh1约为1.0×10-3.8
D.当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且 减小
第Ⅱ卷(非选择题,共52分)
二、非选择题(本题包含5个小题,计52分)
3. (10分)能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是_____ ;
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2(小数点后保留2位小数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。请写出负极的电极反应为_______________。
1. (12分)“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。(查阅资料:饱和NaClO溶液pH为11)。回答下列问题:
(1)装置A中发生反应的离子方程式为_______。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:______________________________。
②滴定终点的现象为__________________________________________________。
③C瓶溶液中NaClO含量为____________g·L-1。
④若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
2. (10分)“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
(1)碱性锌锰干电池的电解质为KOH,总反应为
Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为__________________________________。
(2)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2 。
(3)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序______。
(4)铜器在潮湿环境中发生的电化学腐蚀如图所示:
环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为______L(标准状况)。
1. (14分)通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)FeCl3溶液呈酸性原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为________________________。(填序号)
(4)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
2. (6分)在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应,n(NO)随时间的变化如下表:
时间/S
0
10
20
30
40
50
n(NO)/mol
0.2
0.1
0.08
0.07
0.07
0.07
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为___________。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是______
热反应(填:“吸”、“放”)
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是_______。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式 _________ 。
(5)等温时,a、b容器开始体积相等,各充入2molNO 和 1molO2,平衡时NO的转化率a___b(填“大于”“小于”“等于”)