化学卷·2019届江西省南昌市第二中学高二上学期期末考试(2018
南昌二中2017~2018学年度上学期期末考试
高二化学试卷
命题人:游茶英 审题人:沈亚丽
可能用到的相对原子质量:H:1 N:14 C:12 O:16 S:32 Mg:24 Cl:35.5
Cu:64 Fe:56
第Ⅰ卷 选择题
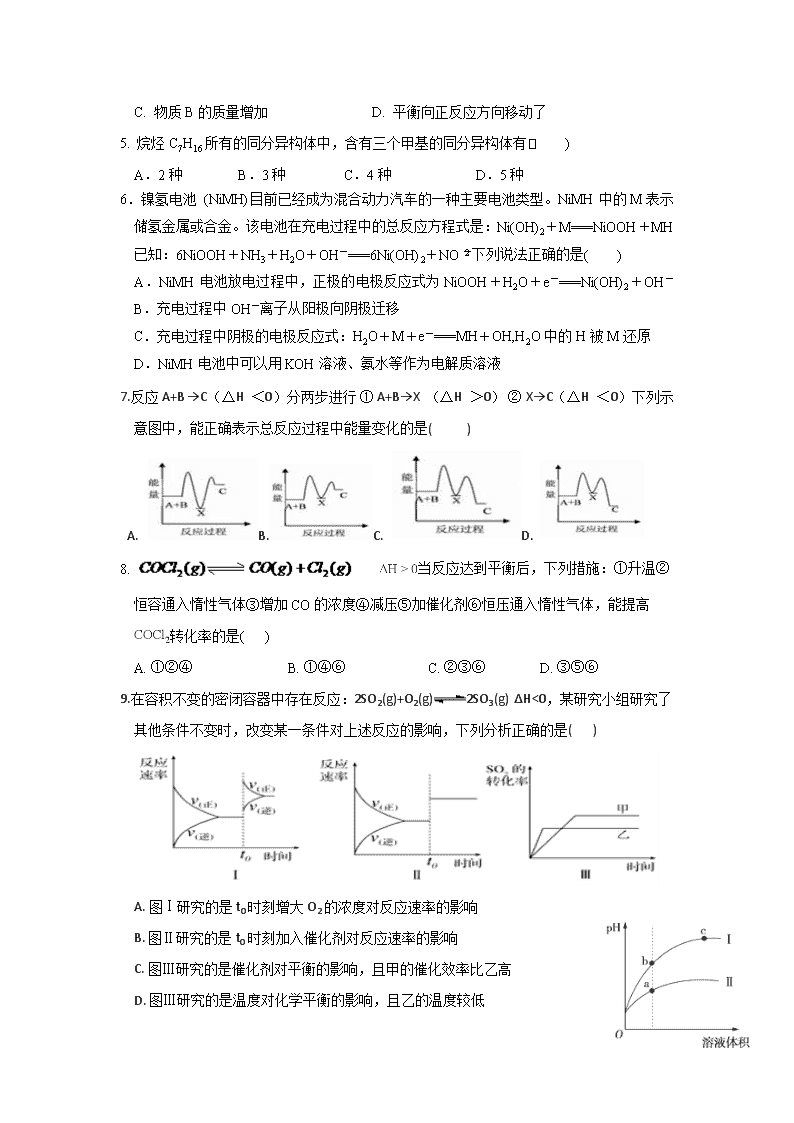
一、选择题(每小题只有一个选项符合题意,每小题3分,共计48分)
1.下列各式中,属于正确的电离方程式的是( )
A. HCO3- + H2O ⇌ H2CO3 + OH- B.HCO3- +OH- = H2O + CO32-
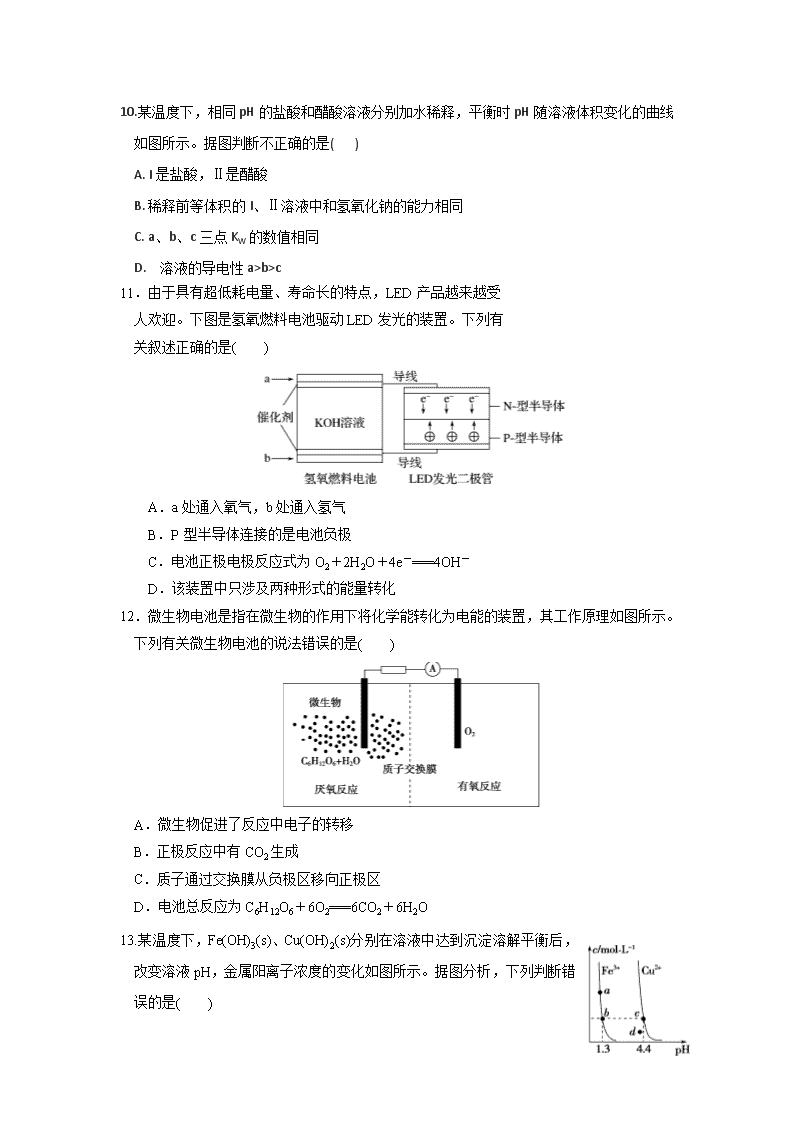
C. NH3 + H+ = NH4+ D.NH3·H2O ⇌ NH4+ + OH-
2.下列有关电解质溶液的说法正确的是( )
A.向0.1molCH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
3.下列事实对应的离子方程式或电极反应式书写正确的是( )
A.用石墨作电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
B.碳酸钠溶液显碱性:CO+2H2O⇌ H2CO3+2OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.在强碱溶液中与NaClO反应生成Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO+3Cl-+H2O+4H+
4. 在一密闭容器中,充入一定量的反应物A,反应达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B的浓度是原来的1.6倍,则下列判断正确的是( )
A. B. 物质A的转化率降低
C. 物质B的质量增加 D. 平衡向正反应方向移动了
5. 烷烃C7H16所有的同分异构体中,含有三个甲基的同分异构体有( )
A.2种 B.3种 C.4种 D.5种
6.镍氢电池 (NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2+M===NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH- B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
7.反应 A+B →C(△H <0)分两步进行 ① A+B→X (△H >0) ② X→C(△H <0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.B.C. D.
8. 当反应达到平衡后,下列措施:①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑥ D. ③⑤⑥
9.在容积不变的密闭容器中存在反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
A. 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻加入催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
10.某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )
A. I是盐酸,Ⅱ是醋酸
B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
C. a、b、c三点KW的数值相同
D. 溶液的导电性a>b>c
11.由于具有超低耗电量、寿命长的特点,LED产品越来越受
人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有
关叙述正确的是( )
A.a处通入氧气,b处通入氢气
B.P型半导体连接的是电池负极
C.电池正极电极反应式为O2+2H2O+4e-===4OH-
D.该装置中只涉及两种形式的能量转化
12.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.微生物促进了反应中电子的转移
B.正极反应中有CO2生成
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
13.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
A.Ksp[Fe(OH)3]
[HC2O4-]>[HCO3-]>[CO32-] B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-] D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(2)白磷与氧气可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1
。根据图示的分子结构和有关数据估算该反应的ΔH=___________。
(3) 25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-amol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和=___________。
(4)在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号
氢氧化钡溶液
的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积变化忽略不计,则c=___________。
20.⑴有机物A和B无论以任何比例混合,其组成的混合物中所含的原子的核外电子总数均不变。
①若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物。写出两组符合上述要求的有机物的分子式:
a、相对分子质量之差为2:A ;B ;
b、相对分子质量相等: A ;B ;
②A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氧衍生物。
则A分子式为 ;B的分子式为 ;符合B分子式的同分异构体有 种。
⑵.烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)2的系统命名是__________________
21.氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
①容器内气体压强保持不变
②吸收y mol H2只需1 mol MHx
③若降温,该反应的平衡常数增大
④若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(3)化工生产的副产物也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解过程中,须将阴极产生的气体及时排出,其原因是_______。
②c( Na2FeO4)随初始c(NaOH)的变化如图2,,请分析N点c(Na2FeO4)低于最高值的原因:_____________。
南昌二中2017~2018学年度上学期期末考试
高二化学试卷参考答案
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
D
D
A
B
B
A
D
B
B
B
C
B
C
D
C
D
二、非选择题
17.(共10分, 每空2分)
(1) ④ (2) ①⑥ (3) ②⑧ (4) ⑤⑦ (5) ⑨
18. (14分)
(1)①阻止OH-进入阳极室,与Cl2发生副反应(1分);阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。(1分)
② 2Cl-+2H2OCl2↑+H2↑+2OH-(2分)
③ d(2分)
(2) ( C ) (2分)
(3) ① PbO2+4H++SO+2e-===PbSO4+2H2O (2分)
② Cu+2H+Cu2++H2↑(2分)
③ 3.92 (2分)
19.(共10分, 每空2分)
(1) ① > ② AC
(2) .(6a+5d-4c-12b) kJ·mol-1
(3) 14-a+b
(4) 4
20.(共10分)
(1)① C4H8;(1分) C3H6O ;(1分) C7H8;(1分) C3H8O3 ;(1分)
② C4H10;(1分) C3H8O ;(1分) 3 (2分)
(2) 2-甲基-3-乙基己烷(2分)
21.(共8分, 每空2分)
(1)<
(2)① ③
(3)①防止Na2FeO4与H2反应使产率降低
②N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
南昌二中2017~2018学年度上学期期末考试
高二化学试卷答题卡
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
17.(共10分, 每空2分)
(1)____________ (2)____________ (3)______________
(4)_____________ (5)_____________
18. (14分)
(1)①___________________________________________________________________________________________________________________________________________
②___________________________________________
③ __
(2) ______
(3)① __________________________________________________________
② _________________________________________
③___________
19.(共10分, 每空2分)
(1) ①_______ ②_______
(2) _______________________________
(3) ____________
(4) ____________
20.(共10分)
(1)① a ____________ _______________
b: ________ ______
②
(2) ______________________________________
21.(共8分, 每空2分)
(1)___________(2)____________
(3)①__________________________________________________
②__________________________________________________