- 2021-05-31 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省临漳县第一中学高二上学期期中考试化学试题 Word版
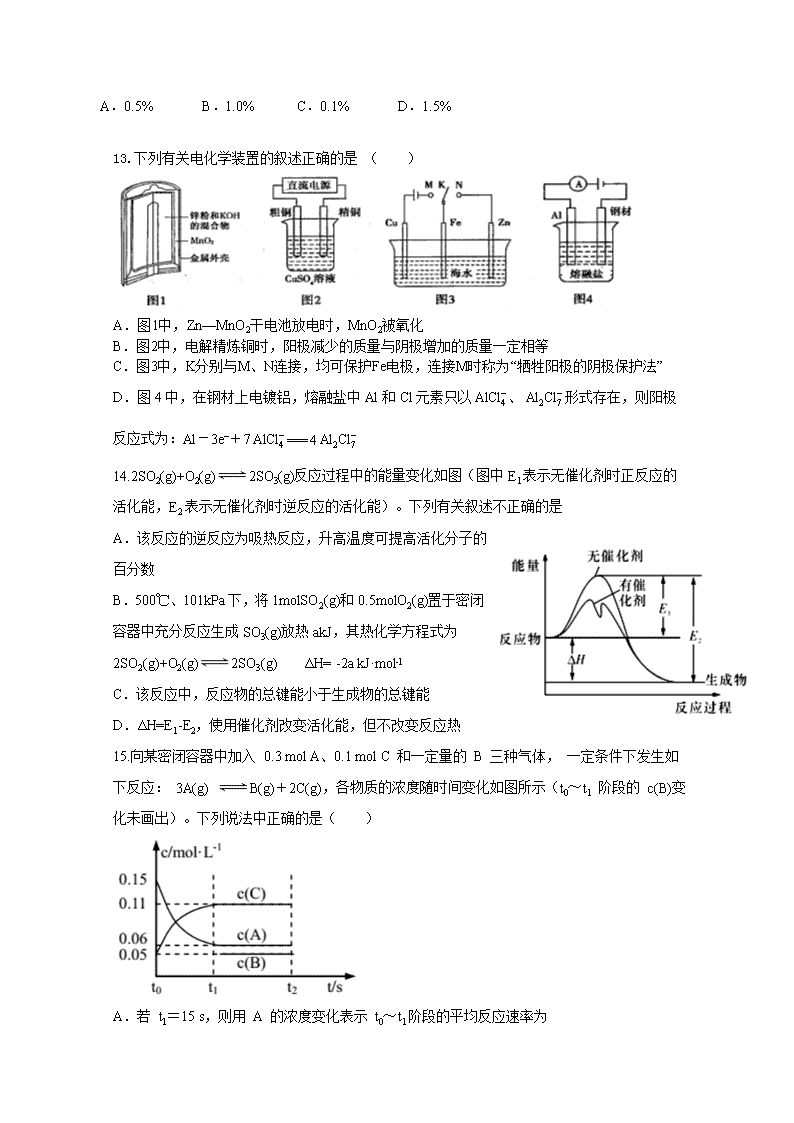
2018-2019学年河北省临漳县第一中学高二上学期期中考试化学试题 考试时间90分钟,满分100分 一、 选择题(1-15每题2分,16-25每题3分,共60分)。 1.下列有关电解质的说法正确的是( ) A.强电解质一定是离子化合物 B.强电解质溶液的导电能力一定比弱电解质强 C.易溶性强电解质的稀溶液中不存在溶质分子 D.由于硫酸钡难溶于水,所以硫酸钡是弱电解质 2.下列说法中正确的是( ) A.能自发进行的反应都是放热反应 B.在一定条件下,吸热反应可以自发进行 C.凡是熵增加的反应一定能自发进行 D.放热的熵增加的反应不一定能够自发进行 3.下列说法不正确的是( ) A.在其他外界条件不变的情况下,增大压强,不能增大活化分子的百分数 B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 C.因焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 D.ΔH<0、ΔS>0的反应在任何温度下都能自发进行 4.100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量 ( ) A.硫酸铜溶液 B.碳酸钠溶液 C.硝酸钠溶液 D.硫酸钾溶液 5.下列事实能用勒沙特列原理解释的是( ) ①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 ②用排饱和食盐水法收集Cl2 ③高压比常压有利于提高合成氨的产率 ④高温下合成氨速率较快 ⑤工业制取金属钾Na(l)+ KCl(l) NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来 A. ②③⑤ B. ①②③⑤ C.①②③④⑤ D.②④⑤ 6. 已知常温时红磷比白磷稳定,在下列反应中:( ) 4P(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol 4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol 若a、b均大于零,则a和b的关系为 ( ) A.a<b B.a=b C.a>b D.无法确定 7.下列依据热化学方程式得出的结论正确的是( ) A. 等量固态硫燃烧比气态硫燃烧放热多 B. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1 C. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b D. 已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量 8. 只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( ) A. K值不变,平衡可能移动 B. K值变化,平衡一定移动 C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化 9.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2。下列说法中错误的是( ) A. 原电池放电时,负极上发生反应的物质是Zn B. 溶液中OH- 向正极移动,K+、 H+ 向负极移动 C. 工作时,负极区溶液pH减小,正极区pH增大 D. 负极上发生的反应是Zn+2OH--2e-=Zn(OH)2 10.根据下列有关实验得出的结论一定正确的是( ) 选项 方法 结论 A 实验室用锌粒和稀H2SO4制氢气,滴加少量CuSO4溶液 可以加快制备氢气的反应速率 B 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 氧化性:H2O2>Fe3+ C 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 反应速率: 粉状大理石<块状大理石 D 吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 则该反应的△S<0 11.在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是 ( ) A.X是电源的负极 B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ C.总反应可表示为:H2O+CO2=H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是1︰1 12.取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度为( ) A.0.5% B.1.0% C.0.1% D.1.5% 13.下列有关电化学装置的叙述正确的是 ( ) A.图1中,Zn—MnO2干电池放电时,MnO2被氧化 B.图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 C.图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法” D.图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以、形式存在,则阳极反应式为:Al-3e-+7=== 4 14.2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是 A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 B.500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH= -2a kJ·mol-l C.该反应中,反应物的总键能小于生成物的总键能 D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热 15.向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) B(g)+2C(g),各物质的浓度随时间变化如图所示(t0~t1 阶段的 c(B)变化未画出)。下列说法中正确的是( ) A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1 B.t1时该反应达到平衡, A 的转化率为 60% C.该容器的容积为2 L,B的起始的物质的量为 0.02 mol D.t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)B(g)+2C(g) ΔH=-50a kJ·mol-1分) 16.下列由生产或实验事实得出的相应结论不正确的是( ) 选项 生产或实验事实 结论 A 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 当其他条件不变时,升高温度,化学反应速率增大 B 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 增大气液接触面积,使SO3的吸收速率增大 C 在容积可变的密闭容器中发生反应:2NH3(g)N2H4(l)+H2(g),把容器的容积缩小一半 正反应速率增大,逆反应速率减小 D 往A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 当其他条件不变时,催化剂可以增大化学反应速率 17.已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是( ) A.该温度高于25℃ B.由水电离出来的H+的浓度为1×10-10 mol·L-1 C.加入NaHSO4晶体抑制了水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)减小 18.一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)2B(g)+C (g),下列能说明反应已达平衡状态的是( ) A. 混合气体的密度保持不变 B. 容器内B、C的浓度之比为2∶1 C. B的生成速率等于C的消耗速率 D. 气体的体积分数保持不变 19.在恒容密闭容器中存在平衡:CO(g)+H2O(g)CO2(g)+H2(g) ΔH。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( ) A.反应CO(g)+H2O(g)CO2(g)+H2(g)的ΔH>0 B.在T2K时,若反应处于状态D,则一定有ν正<ν逆 C.平衡状态A与C相比,平衡状态A的c(CO)小 D.若T1K、T2K时的平衡常数分别为K1、K2,则K1查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档