- 2021-05-31 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考王中考命题研究贵阳化学教材知识梳理课时碳和碳的氧化物
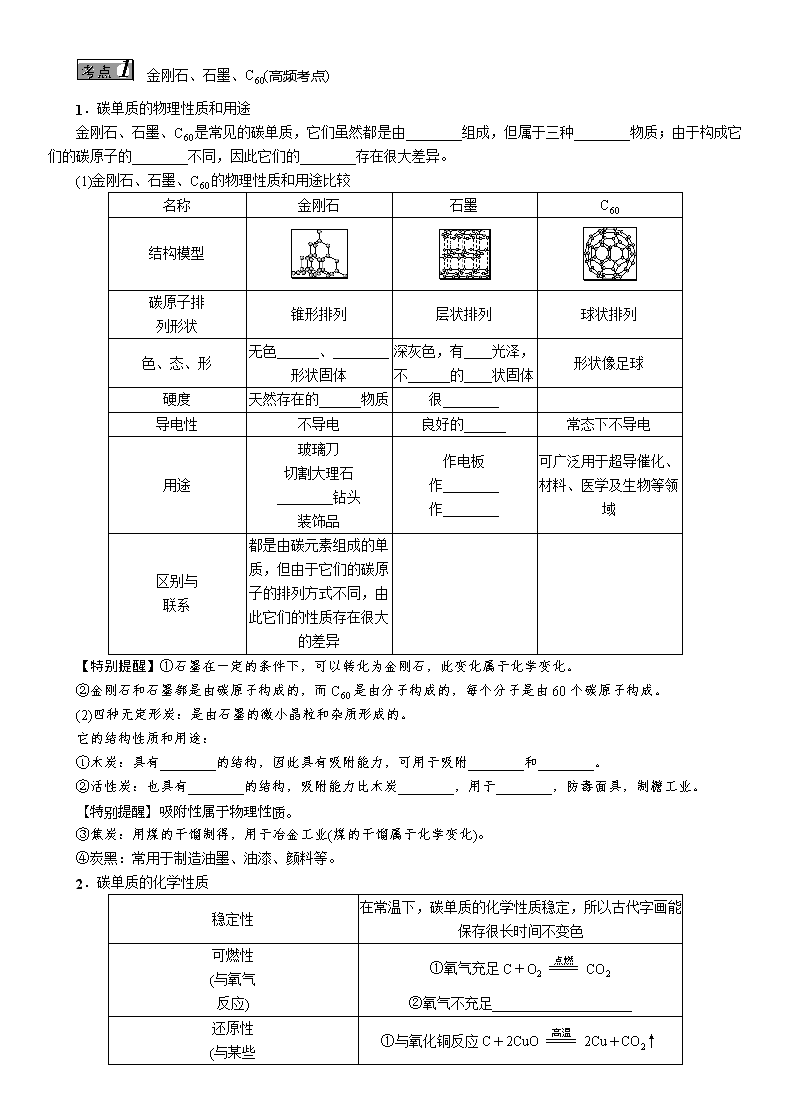
课时2 碳和碳的氧化物 ,贵阳五年中考命题规律) 年份 题型 题号 考查知识点及内容 分值 2015 非选择 33(1)(2); 35(2)(3)(4) 碳的化学性质;二氧化碳的化学性质 2+3 2014 非选择 31;11(2); 33(4) 碳单质的性质和用途;二氧化碳的性质和实验室制取 2+2+1 2013 非选择 35(4); 39(2)(3) 碳单质的性质;二氧化碳的实验室制取 1+2 2012 填空、探究 35(1)(5); 39(1)(2) 碳、一氧化碳、二氧化碳的性质;二氧化碳的实验室制取 3+5 2011 选择、探究 2;39 一氧化碳、二氧化碳对环境的影响;二氧化碳的实验室制取 2+2 碳和碳的氧化物是贵阳中考的必考内容。分值为3~8分。题型以选择题和填空题为主,也会在实验探究题出现,一般为综合命题。预计2016年贵阳中考以单质碳的性质和用途、二氧化碳和一氧化碳、二氧化碳对人体和环境的影响、二氧化碳的实验室制取为考查重点,且以填空题、实验探究题的形式考查。 ,贵阳五年中考真题演练) 单质碳的性质和用途 1.(2014贵阳中考31题2分)在宏观、微观和符号之间建立联系,是化学学科的特点。如图是某化学反应的微观过程示意图,请回答相关问题。 (1)A中物质的化学式分别是________。 (2)请在B框内将相关粒子的图形补充完整。 (3)如图所示反应的化学方程式为________________________________________________________________________。 (4)该反应的生成物所属类别是________,写出它的一种用途________。 二氧化碳和一氧化碳 2.[2014贵阳中考11(2)题2分]NaOH和Ca(OH)2都能与二氧化碳反应,写出其中一个反应的化学方程式________________________________________________________________________。 二氧化碳的实验室制取 3.[2014贵阳中考33(4)题1分]实验室制取气体是化学学习的基本实验技能之一,请根据下图回答相关问题: 乙同学用上图装置制取二氧化碳,该反应的化学方程式为____________________,收集到的二氧化碳中可能含有的杂质有________,要除去这些杂质用到的试剂先后有____________________________。 4.(2012贵阳中考39题5分)科学探究是一种重要的学习方式。锁定探究目的,理清探究思路是探究过程中分析问题时常用的方法。请利用图中的装置对相关问题展开探究。 【实验目的】①探究二氧化碳的制备和性质。②探究酸碱盐的性质。 【实验信息】 ①大理石中的杂质不参加反应且难溶于水。②B装置中铜网用粗铜丝固定,铜网和粗铜丝不参加反应。③探究过程不考虑空气中的二氧化碳对实验的影响。 【实验步骤】 ①连接仪器,检查装置气密性。将块状大理石置于B装置的铜网上。②关闭止水夹K2,打开止水夹K1,打开分液漏斗活塞,通过分液漏斗向B装置中加入稀盐酸,使其浸没大理石后关闭分液漏斗活塞。 (1)B装置中发生反应的化学方程式为______________________,该反应属于基本反应类型中的________。 (2)A装置中的实验现象是________________,发生反应的化学方程式为__________________。当B装置中的物质仍在反应时,关闭止水夹K1,打开止水夹K2。一段时间后可观察到:B装置中反应逐渐停止,C、D装置中溶液为红色,且D装置中有沉淀生成。 (3)D装置中发生反应的化学方程式为________________________________________________________________________ ________________________________________________________________________。 二氧化碳对环境的影响 5.(2011贵阳中考2题2分)“生态文明贵阳会议”为我市“三创一办”的深化注入了新的内涵,而2010年会议期间公布的《贵阳市2010~2020低碳发展行动计划(纲要)》则把生态文明建设从“责任”落实到“行动”。下列做法与低碳行动计划不相符的是( ) A.保护好贵阳市环城林带的森林资源 B.生活中,大量使用塑料袋和塑料盒 C.公交车使用液化天然气、乙醇等清洁燃料 D.街道照明,大量使用太阳能LED灯,中考考点清单) 金刚石、石墨、C60(高频考点) 1.碳单质的物理性质和用途 金刚石、石墨、C60是常见的碳单质,它们虽然都是由________组成,但属于三种________物质;由于构成它们的碳原子的________不同,因此它们的________存在很大差异。 (1)金刚石、石墨、C60的物理性质和用途比较 名称 金刚石 石墨 C60 结构模型 碳原子排 列形状 锥形排列 层状排列 球状排列 色、态、形 无色______、________形状固体 深灰色,有____光泽,不______的____状固体 形状像足球 硬度 天然存在的______物质 很________ 导电性 不导电 良好的______ 常态下不导电 用途 玻璃刀 切割大理石 ________钻头 装饰品 作电板 作________ 作________ 可广泛用于超导催化、材料、医学及生物等领域 区别与 联系 都是由碳元素组成的单质,但由于它们的碳原子的排列方式不同,由此它们的性质存在很大的差异 【特别提醒】①石墨在一定的条件下,可以转化为金刚石,此变化属于化学变化。 ②金刚石和石墨都是由碳原子构成的,而C60是由分子构成的,每个分子是由60个碳原子构成。 (2)四种无定形炭:是由石墨的微小晶粒和杂质形成的。 它的结构性质和用途: ①木炭:具有________的结构,因此具有吸附能力,可用于吸附________和________。 ②活性炭:也具有________的结构,吸附能力比木炭________,用于________,防毒面具,制糖工业。 ③焦炭:用煤的干馏制得,用于冶金工业(煤的干馏属于化学变化)。 ④炭黑:常用于制造油墨、油漆、颜料等。 2.碳单质的化学性质 稳定性 在常温下,碳单质的化学性质稳定,所以古代字画能保存很长时间不变色 可燃性 (与氧气 反应) ①氧气充足C+O2CO2 ②氧气不充足____________________ 还原性 (与某些 氧化物 反应) ①与氧化铜反应C+2CuO2Cu+CO2↑ ②与氧化铁反应______________________ ③与CO2反应C+CO22CO 碳的还原性广泛用于冶金工业 【特别提醒】①碳在常温下性质稳定,所以用碳单质作还原剂与其他物质反应,必须是高温条件。 ②碳与氧气反应有两种生成物,说明反应物的量不同生成物也不同。 ③还原性:物质在化学反应中夺取氧的性质,夺取氧的物质,发生氧化反应,失去氧的物质发生还原反应。 3.实验突破:碳粉还原氧化铜 (1)实验过程 实验药品 碳粉、氧化铜粉、澄清石灰水 反应原理 C+2CuO2Cu+CO2↑ 实验装置 实验步骤 ①连接装置;②检验装置气密性;③装药品,把装置固定在铁架台上;④高温加热;⑤实验完毕先将导气管从澄清石灰水中取出,再熄灭酒精灯 实验现象 ①实验过程中观察到澄清石灰水变浑浊;②将冷却后试管中的粉末倒在纸上,观察有红色物质生成 结论 碳粉与氧化铜反应,生成CO2和Cu (2)选用装置分析:因为反应条件是高温,所以采用酒精灯加网罩(或者用酒精喷灯)。 (3)实验现象分析:反应物为碳粉和氧化铜。虽然是高温加热,但其反应速度很缓慢,生成的Cu夹杂在黑色粉末中,需要将粉末倒出来,铺平在纸上观察。 二氧化碳和一氧化碳 二氧化碳的分子中含有两个氧原子,一氧化碳的分子中含有一个氧原子,同为碳的氧化物,因分子的________,使得它们的________有很大的不同。 1.二氧化碳与一氧化碳物理性质的比较 二氧化碳 一氧化碳 色、味、态 ________色、无味、气态 ________、____________、____________ 密度(空气的平均相对分子质量为29) ________大(相对分子质量为44,比29大) ________略小(相对分子质量比空气略小) 溶解性 ________溶于水 ________溶于水 2.二氧化碳的化学性质 (1)二氧化碳既________,也________。 ①现象:下层的蜡烛________熄灭,上层的蜡烛________熄灭; ②结论:二氧化碳不能燃烧,也不支持燃烧(化学性质),二氧化碳的密度比空气大(物理性质); ③应用:CO2可用于灭火,常用的灭火器中盛装的灭火剂就是CO2,CO2灭火,既利用了CO2不能燃烧,也不支持燃烧的性质,也利用了密度比空气大的性质。 (2)与水的反应 实验①: 将CO2气体通入紫色石蕊溶液中 现象:紫色石蕊溶液变________ 结论:CO2与水反应生成________ 反应的化学方程式为H2O+CO2===H2CO3 一段时间后给试管加热 ________消失,溶液变成________ ________不稳定,加热易分解 反应的化学方程式为:H2CO3H2O+CO2↑ 实验②(变式实验): 将用紫色石蕊溶液染成紫色的干燥的四朵纸花做如下四个小实验。 序号 Ⅰ Ⅱ Ⅲ Ⅳ 现象 纸花由紫变________ 纸花不 ________ 纸花不 ________ 纸花由 ________ 分析 醋酸能使紫色石蕊溶液变红 水不能使紫色石蕊溶液变红 CO2不能 使紫色石蕊溶液变红 碳酸能使紫色石蕊溶液变红 将第Ⅳ朵纸花取出用吹风机烘干,红色________。 以上实验说明A:CO2与水反应生成了H2CO3,______________能使紫色的石蕊溶液____________,B:碳酸________,受热易分解。 【点拨】醋酸作用:醋酸能使紫色的石蕊溶液变红,醋酸属于酸,通过Ⅰ和Ⅳ对比,能使紫色石蕊溶液变红,证明有酸生成,即有碳酸生成。 (3)与碱反应: ①与氢氧化钙反应;现象:澄清石灰水变________;结论:CO2能与碱反应;化学方程式:______________;应用:此反应常用于检验CO2气体。 ②与氢氧化钠反应现象:插入NaOH溶液中的试管水位上升的最高。 结论:氢氧化钠能与CO2反应 化学方程式:________________________________________________________________________ 分析:水能与CO2反应:水位上升;氢氧化钙能与CO2反应:水位上升(高于水);氢氧化钠能与CO2反应:水位上升[高于Ca(OH)2溶液]。通过对比,说明NaOH溶液吸收试管中的CO2效果________。 应用:除去混合气体中的CO2,用________吸收效果最好。 3.一氧化碳 (1)一氧化碳的化学性质 化学性质 概述 化学方程式 用途 可燃性 CO燃烧放出大量的热,火焰呈蓝色 2CO+O22CO2 作燃 料 毒性 CO极易与血液中的血红蛋白结合,造成生物体缺氧,严重时危及生命 还原性 CO夺取金属氧化物中的氧,而发生氧化反应(还原能力比碳粉强) CO+CuOCu+CO2 3CO+Fe2O32Fe+3CO2 冶炼 金属 【特别提醒】CO有剧毒,冬天用木炭火取暖时,要注意室内通风,防止CO中毒。 (2)CO与CO2的相互转化 转化 化学方程式 CO转化为CO2 2CO+O22CO2 CO2转化为CO CO2+C2CO (3)鉴别和除杂: ①鉴别CO和CO2根据性质不同的方法: A.点燃 B.通入(或加入)澄清石灰水 C.通入(或加入)紫色石蕊溶液 ②除杂: A.CO2中混有CO:通过灼热的氧化铜;B.CO中混有CO2,通过澄清石灰水(或NaOH溶液) 二氧化碳对生活和环境的影响(高频考点) 1.二氧化碳的用途: ________,________,固态CO2(干冰)作制冷剂,化工产品的原料,光合作用等。 2.二氧化碳对人体健康的影响: ________无毒,但二氧化碳________。在进入久未开启的菜窖、干涸的深井和岩洞底部之前,必须先做________。 3.自然界中碳(元素)的循环: 二氧化碳有机物(食物和燃料等) 4.温室效应: (1)二氧化碳属于________,CO2的浓度____________,会造成环境的________。臭氧(O3),甲烷(CH4),氟氯化碳(氟利昂)都属于________。 (2)两面性: 利:有了温室效应,全球平均地表温度才提高到目前适合________的适宜温度。 弊:可以导致全球气温升高,两极冰山融化,海平面升高淹没部分土地和城市,导致________,农业________。 (3)缓冲措施 ①控制使用煤、________、________等化石燃料,更多地利用________、________、地热能、核能等清洁能源。 ②促进节能产品和技术的进一步________和________,提高生产效率和使用效率。 ③大力________,严禁乱砍滥伐森林。 ④采用物理或化学方法,人工吸收二氧化碳。 【特别提醒】二氧化碳不是污染物,CO2的浓度过高,会导致温室效应,对环境造成严重影响,CO2参与自然界中“碳循环”,空气中不能没有CO2。 二氧化碳的实验室制取(高频考点) 1.二氧化碳的实验室制取 实验药品 块状大理石(石灰石)、稀盐酸 反应原理 CaCO3+2HCl===CaCl2+H2O+CO2↑ 实验装置 ①此发生装置适用于固体与液体反应制取气体,不加热;②收集装置,适用于密度比空气大,不与空气发生反应的气体 操作步骤 ①连接仪器;②检验装置的气密性;③装入药品(先装石灰石,再加入稀盐酸);④收集气体 验满方法 将燃着的木条伸入到集气瓶口,若观察到燃着的木条熄灭,说明CO2已收集满 检验方法 将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,则证明收集到的气体是二氧化碳 2.实验室制取二氧化碳选用药品分析 实验室制取二氧化碳是用块状石灰石(或大理石)和稀盐酸反应,反应速度适中,现象明显,便于操作和观察现象。 (1)不用粉状碳酸钙、碳酸钠、碳酸钾,因为粉末状物体与稀盐酸反应时,接触面大,反应速度快,不便于操作和观察现象,不利于对反应的控制和气体的收集。 (2)不用浓盐酸与石灰石反应,因为浓盐酸代替稀盐酸:①反应速率快;②浓盐酸有挥发性,制取的CO2中混有HCl气体,得到的气体不纯。 (3)不用稀硫酸代替稀盐酸与石灰石反应,因为稀硫酸与石灰石反应,生成微溶于水的硫酸钙覆盖在石灰石的表面,阻止了反应的继续进行。 3.其他装置及分析 装 置 图 装置 优点 安装简便 可以控制稀盐酸的滴加速度,从而控制反应速度 可随时控制反应的发生与停止 设问: (1)实验室制取CO2的反应化学方程式:________________________________________________________________________ ________________________________________________________________________。 (2)如图检验装置气密性的方法是________________________________________________________________________ ________________________________________________________________________。 (3)如图收集CO2气体,应从________端进入。 (4)用块状大理石与稀盐酸反应制取二氧化碳,而不用粉末状碳酸钙与稀盐酸反应,原因是________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 ,中考重难点突破) 碳单质的性质和用途 【例1】(2014临沂中考)在书写具有保存价值的档案时,最好使用( ) A.铅笔 B.纯蓝墨水笔 C.碳素墨水笔 D.圆珠笔 【解析】 铅笔芯由石墨和粘土制成,附着力差,易被擦除,A错误;纯蓝墨水见光易分解,导致褪色,B错误;碳素墨水的主要成分是碳,在常温下,碳的化学性质稳定,适合书写具有保存价值的档案,C正确;圆珠笔水见光易分解,导致褪色,D错误。故选C。 1.(2016原创)下列关于碳单质及其化合物用途的说法中错误的是( ) A.金刚石可以用于刻划玻璃 B.石墨粉末可以作润滑剂 C.二氧化碳可以充灌探空气球 D.一氧化碳用于炼铁 二氧化碳和一氧化碳 【例2】(2014衡阳中考)下列有关CO和CO2的说法中,正确的是( ) A.CO和CO2均具有可燃性 B.CO和CO2均能与H2O反应 C.CO和CO2的密度均大于空气的密度 D.CO和CO2在一定条件下可以相互转化 【解析】 A × 一氧化碳具有可燃性,二氧化碳不能燃烧,无可燃性 B × 二氧化碳能与水反应,一氧化碳不能与水反应 C × 二氧化碳密度比空气大,一氧化碳密度比空气略小 D √ 一氧化碳燃烧可转化成二氧化碳,二氧化碳可在高温下被碳还原成一氧化碳 2.(2014陕西中考)今年5月,中俄签署了东线天然气合作协议。天然气不充分燃烧时会产生炭黑或一氧化碳。 (1)CO具有还原性,写出其在工业上的一种具体用途:________________________________________________________________________。 (2)CO与CO2可以相互转化。CO2在高温下与 ________________________________________________________________________。 (3)将CO2通入紫色石蕊溶液中,溶液变红的原因是________________________________________________________________________。 二氧化碳的制取 【例3】(2015安顺中考)下图是实验室制取气体的一些装置,据图回答有关问题。 (1)写出指定仪器的名称:①________;②________; (2)写出一个实验室用装置B制取气体的反应的化学方程式________________________________________________________________________; (3)实验室在常温下用块状电石与水反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是________(填装置序号);如果用E图所示装置收集乙炔,气体应从________(选填“a”或“b”)端管口通入。 【解析】 (1)仪器名称:①试管;②集气瓶;(2)装置B可用于作制取CO2的发生装置,它适用固体跟液体反应,不加热。所以用装置B制取CO2的化学方程式为CaCO3+2HCl===CaCl2+H2O+CO2↑;(3)块状电石固体与水反应,可不加热,且要控制加入水的速率,选择A,(B不能控制加入水的速率);收集乙炔气体用排水法,气体应从E装置a端管口通入。 3.(2014梅州中考)某学习小组利用下图仪器或装置进行气体制备,回答有关问题: (1)写出仪器a的名称________。 (2)若要在实验室制取二氧化碳气体,其发生装置可选用图中的________(填序号)进行组装,连接玻璃管和胶皮管的操作:先把玻璃管口________,然后稍稍用力即可把玻璃管插入胶皮管内。 (3)要制得干燥的二氧化碳,可在收集装置前增加盛有________的洗气瓶。 (4)实验室收集氧气和二氧化碳都可用到的装置是________(填序号)。 (5)用澄清石灰水检验二氧化碳,其反应的化学方程式为________________________________________________________________________。 【解题技巧】解答此类试题时,首先要明白气体的制取原理,然后根据制取原理选择合适的制取装置;明确气体的性质,选择合适的收集装置及气体性质的验证方法。 二氧化碳对环境的影响 【例4】(2015贵阳模拟)今年以来,全国各地出现了几次较为严重的雾霾天气,河北各地也受到严重的影响,再次引起人们对空气质量的关注,下列举措有利于改善空气质量的是( ) A.露天焚烧垃圾和秸秆 B.燃煤火力发电 C.工厂废气处理后排放 D.鼓励开私家车出行 【解析】 工厂废气处理后再排放,有利于改善空气质量。露天焚烧垃圾和秸秆、燃煤发电、汽车排放的气体均会对大气造成不同程度的污染。故选C。 4.(2014咸宁中考)“低能耗”、“低废水”、“低废弃物”是低碳理念的重要内涵。下列做法不符合“低碳”要求的是( ) A.推广无纸化办公 B.循环使用生活用水 C.夏天将空调温度调得很低 D.减少使用一次性筷子查看更多