- 2021-05-21 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省重点中学2021届高三上学期总复习阶段性检测考试 化学 Word版含答案
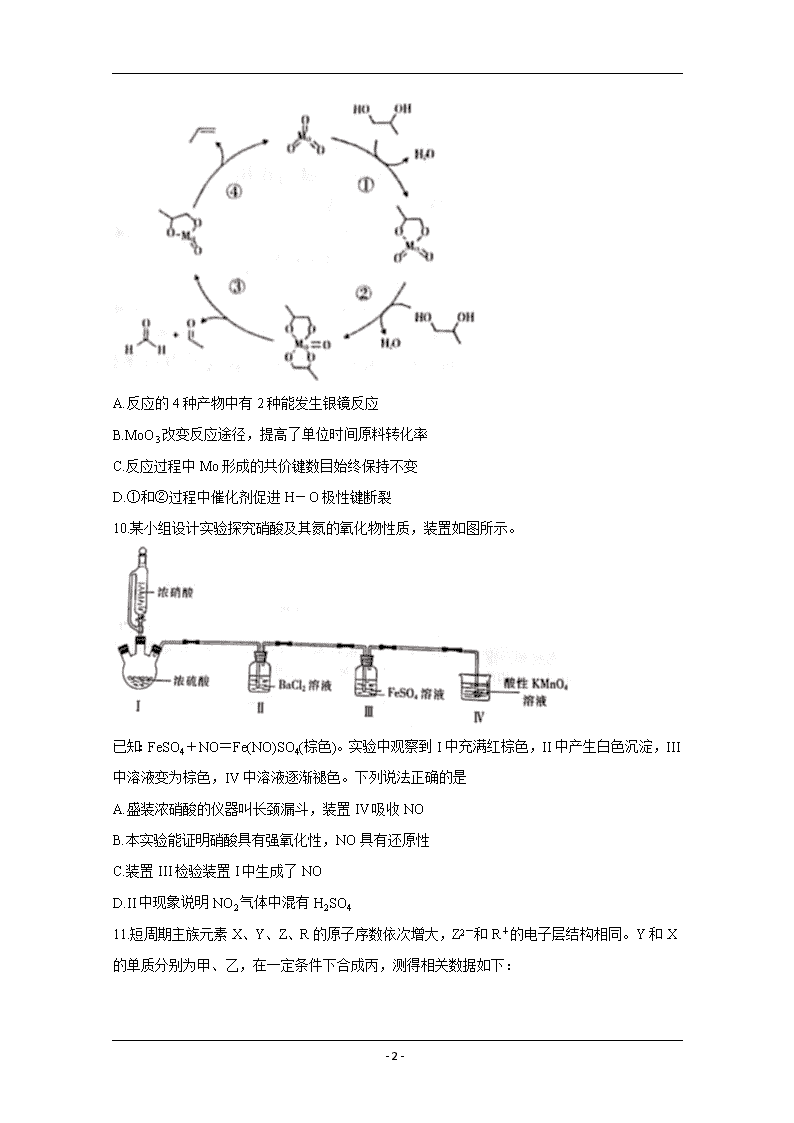
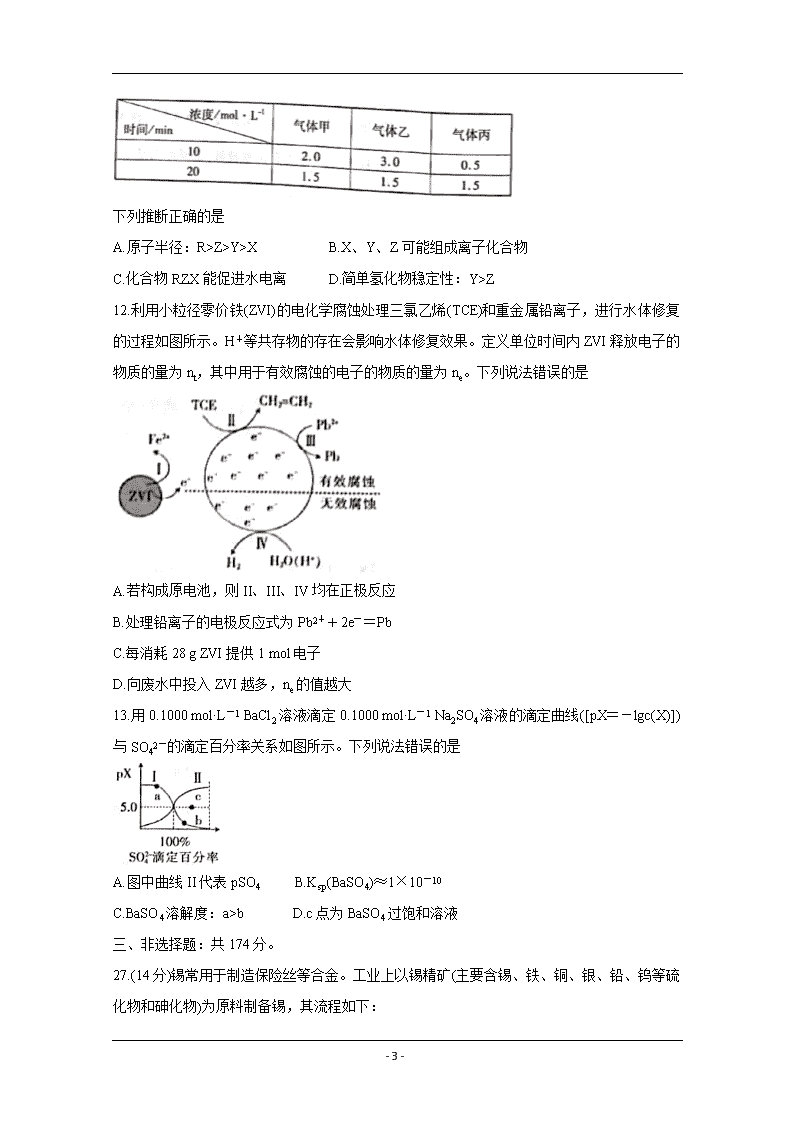
- 1 - 2020-2021 学年高三总复习阶段性检测考试 理科综合卷 化学部分 注意事项: 1.考试范围: 化学——必修 1,必修 2,选修 4。 2.答卷前,考生务必将自己的姓名准考证号等填写在答题卡和试卷指定位置上。 3.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动, 用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试 卷上无效。 4.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 Ag 108 一、选择题:本题共 13 小题,每小题 6 分,共 78 分。在每小题给出的四个选项中,只有一 项是符合题目要求的。 7.传统文化是我国古文明的瑰宝。下列有关解读错误的是 8.α-紫罗兰酮从一种桂花中提取,主要用于配制香精,它的键线式如图所示。已知:与四个 不同原子或原子团相连的碳原子叫手性碳原子。下列有关α-紫罗兰酮的说法正确的是 A.分子中有 10 个碳原子一定共平面 B.与同碳原子数的芳香醇互为同分异构体 C.与足量 Br2 反应的产物分子中含 4 个手性碳原子 D.1 mol α-紫罗兰酮和 3 mol H2 完全反应的产物化学式为 C13H20O 9.在 MoO3 作用下,HOCH2CH(OH)CH3 发生反应的历程如图,下列说法错误的是 - 2 - A.反应的 4 种产物中有 2 种能发生银镜反应 B.MoO3 改变反应途径,提高了单位时间原料转化率 C.反应过程中 Mo 形成的共价键数目始终保持不变 D.①和②过程中催化剂促进 H-O 极性键断裂 10.某小组设计实验探究硝酸及其氮的氧化物性质,装置如图所示。 已知:FeSO4+NO=Fe(NO)SO4(棕色)。实验中观察到 I 中充满红棕色,II 中产生白色沉淀, III 中溶液变为棕色,IV 中溶液逐渐褪色。下列说法正确的是 A.盛装浓硝酸的仪器叫长颈漏斗,装置 IV 吸收 NO B.本实验能证明硝酸具有强氧化性,NO 具有还原性 C.装置 III 检验装置 I 中生成了 NO D.II 中现象说明 NO2 气体中混有 H2SO4 11.短周期主族元素 X、Y、Z、R 的原子序数依次增大,Z2-和 R+的电子层结构相同。Y 和 X 的单质分别为甲、乙,在一定条件下合成丙,测得相关数据如下: - 3 - 下列推断正确的是 A.原子半径:R>Z>Y>X B.X、Y、Z 可能组成离子化合物 C.化合物 RZX 能促进水电离 D.简单氢化物稳定性:Y>Z 12.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯(TCE)和重金属铅离子,进行水体修复 的过程如图所示。H+等共存物的存在会影响水体修复效果。定义单位时间内 ZVI 释放电子的 物质的量为 nt,其中用于有效腐蚀的电子的物质的量为 ne。下列说法错误的是 A.若构成原电池,则 II、III、IV 均在正极反应 B.处理铅离子的电极反应式为 Pb2++2e-=Pb C.每消耗 28 g ZVI 提供 1 mol 电子 D.向废水中投入 ZVI 越多,ne 的值越大 13.用 0.1000 mol·L-1 BaCl2 溶液滴定 0.1000 mol·L-1 Na2SO4 溶液的滴定曲线([pX=-lgc(X)]) 与 SO42-的滴定百分率关系如图所示。下列说法错误的是 A.图中曲线 II 代表 pSO4 B.Ksp(BaSO4)≈1×10-10 C.BaSO4 溶解度:a>b D.c 点为 BaSO4 过饱和溶液 三、非选择题:共 174 分。 27.(14 分)锡常用于制造保险丝等合金。工业上以锡精矿(主要含锡、铁、铜、银、铅、钨等硫 化物和砷化物)为原料制备锡,其流程如下: - 4 - 请回答下列问题: (1)锡精矿在空气中焙烧,使硫元素和砷元素转化为易挥发的 SO2 和 As2O3,可用 (填 化学式)溶液吸收尾气。 (2)“焙烧”中将 WS2 转化成 WO3,用 10%纯碱溶液“碱浸”将 WO3 转化成易溶性的 Na2WO4 并放出气体,写出离子方程式: 。 (3)“熔炼”时使用焦炭粉,粉碎焦炭的目的是 ;如果炭还原 SnO2 时生成锡和 CO、CO2(体积比 3:1),写出化学方程式: 。 (4)利用如图所示装置精炼锡。Y 极材料是 (填化学式),阳极最先发生反应的电极反 应式为 。 (5)精炼锡的阳极泥主要有 Cu、Ag 和 PbSO4,回收铜和银的流程如下: ①下列说法正确的是 (填字母)。 A.KClO3 氧化 Cu 和 Ag B.只能用置换法提取铜 C.滤渣 2 的主要成分是 PbSO4 D.浸取 2 需要“高温” ②浸液 2 的主要成分是[Ag(NH3)2]Cl,氨水溶解氯化银的离子方程式为 。(已 知[Cu(NH3)4]SO4 的电离方程式书写:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-) ③若制得 4 mol 银,至少需要水合肼(N2H4·H2O) mol(已知:水合肼的氧化产物对环 境友好)。 28.(15 分)滴定法是测定甲醛废水中甲醛含量的一种方法(假设废水不含其他干扰实验的成分)。 实验步骤如下: ①用 KBrO3 固体配制 450 mL c1 mol·L-1 KBrO3 溶液; - 5 - ②取 x mL 上述溶液.加入过量 KBr,加稀硫酸酸化,溶液呈棕黄色; ③向②所得溶液中加入 x mL 废水,溶液呈浅黄色; ④向③所得溶液中加入过量 KI; ⑤用 c2 mol·L-1 标准 Na2S2O3 溶液滴定④中溶液至浅黄色,滴加几滴淀粉溶液,继续滴定至终 点,消耗标准滴定液 y mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6;Na2S2O3 和 Na2S4O6 溶液 均为无色) 请回答下列问题: (1)在步骤①中需要的定量仪器有托盘天平和 。 (2)步骤②中离子方程式为 。 (3)步骤③中必须使溶液呈浅黄色,原因是 ;溴 氧化 HCHO 生成 CO2,写出化学方程式 。 (4)下列情况表明 KI 一定过量的是 (填字母)。 A.n(KI)=6n(KBrO3) B.n(KI)=5n(KBrO3) C.n(KI)>7n(KBrO3) D.n(KI)<6n(KBrO3) (5)滴定终点标志是 ;废水中甲醛的浓度为 mol·L-1。 (6)若上述操作在通风条件下进行,测得结果 (填“偏高”“偏低”或“无影响”)。 29.(14 分)某小组探究 H2(g)+I2(g) 2HI(g) △H (1)已知:H-H、I-I、H-I 键的键能(kJ·mol-1)依次为 436、151、297。上述反应中△H= kJ·mol-1。 (2)在 698.6K 时,向密闭容器中充入 H2(g)、I2(g)发生上述可逆反应,测得有关数据如下: 根据上述数据和平衡常数定义式可以得出的规律是平衡常数只与 有关,与反应物 浓度和反应途径无关。 (3)在恒温恒容条件下发生上述反应,下列情况表明该反应已达到平衡状态的是 (填 字母)。 - 6 - A.混合气体密度保持不变化 B.混合气体总压强保持不变 C.断裂 H-H 和 H-I 键速率之比为 1:2 D.混合气体中 HI 体积分数保持不变 (4)H2(g)+I2(g) 2Hl(g)的反应历程如下:第 1 步,I2 2I(快速平衡);第 2 步,I+H2 H2I(快 速平衡);第 3 步,H2I+I 2HI(慢反应)。 ①第 1 步反应中, (填“放出”或“吸收”)热量。 ②上述三步反应中,活化能最大的是第 (填数字)步反应。 ③第 2 步正反应速率 (填“大于”“小于”或“等于”)第 3 步逆反应速率。 (5)在催化剂作用下,发生反应:H2(g)+I2(g) 2HI(g),温度与速率关系如图所示。 T查看更多