2018-2019学年四川省阆中中学高二上学期开学考试化学试题(Word版)
2018-2019学年四川省阆中中学高二上学期开学考试化学试题
一、 单项选择题(每小题3分,共48分。在每小题所列的四个选项中,只有一项是符合题目要求的,请把答案的字母序号填涂在答题卡上。)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 Mg 24 Al 27 Si 28
P 31 S 32 Cl 35.5 K 39 Ca 40 Fe 56
1.化学与生产、生活密切相关.下列叙述正确的是( )
A.煤的干馏与石油的分馏均属于化学变化
B.BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.14C可用于文物的年代鉴定,14C与13C互为同素异形体
D.葡萄糖注射液不能产生丁达尔现象,不属于胶体
2. 下列物质之间的相互关系错误的是( )
A.CH3CH2OH和CH3OCH3互为同分异构体
B.干冰和冰为同一种物质
C.CH3CH3和CH3CH2CH3互为同系物
D.O2和O3互为同素异形体
3、下列微粒半径大小的比较中,正确的是()
A、Na+
Cl->Na+>Al3+
C、NaY
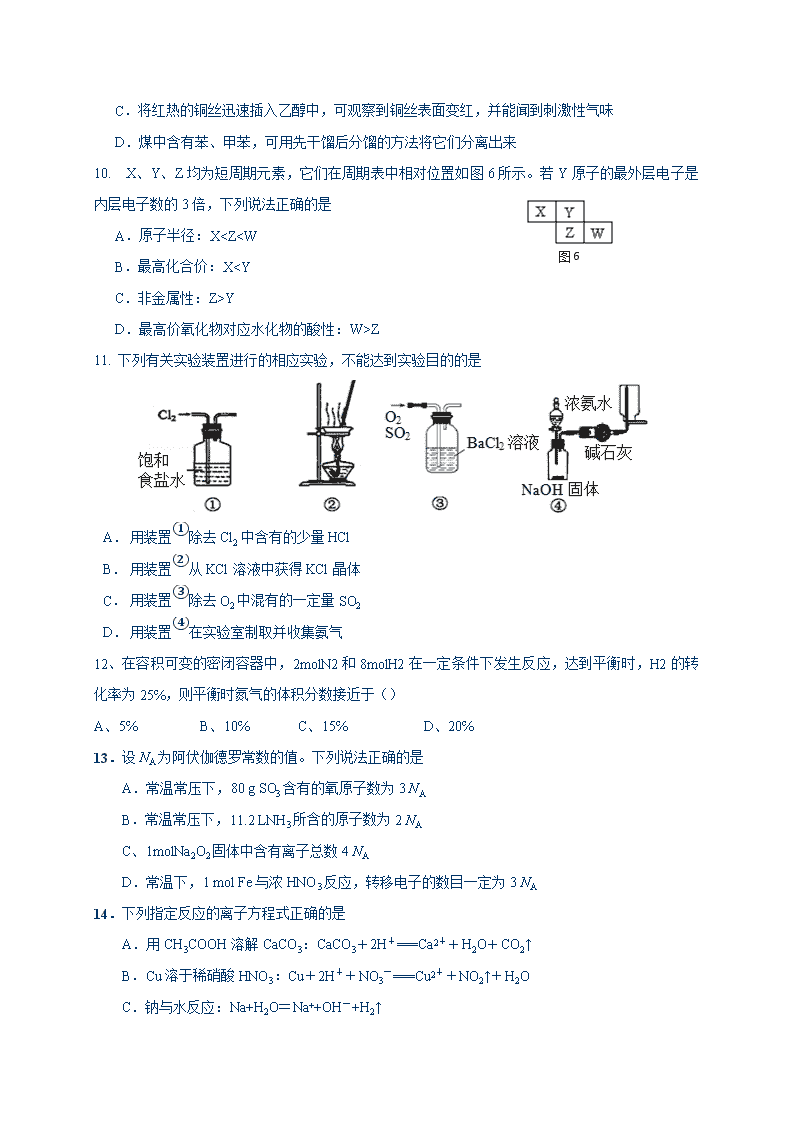
D.最高价氧化物对应水化物的酸性:W>Z
11. 下列有关实验装置进行的相应实验,不能达到实验目的的是
A.
用装置①除去Cl2中含有的少量HCl
B.
用装置②从KCl溶液中获得KCl晶体
C.
用装置③除去O2中混有的一定量SO2
D.
用装置④在实验室制取并收集氨气
12、在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25℅,则平衡时氮气的体积分数接近于()
A、5℅ B、10℅ C、15℅ D、20℅
13.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温常压下,80 g SO3含有的氧原子数为3 NA
B.常温常压下,11.2 LNH3所含的原子数为2 NA
C、1molNa2O2固体中含有离子总数4 NA
D.常温下,1 mol Fe与浓HNO3反应,转移电子的数目一定为3 NA
14.下列指定反应的离子方程式正确的是
A.用CH3COOH溶解CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
B.Cu溶于稀硝酸HNO3:Cu+2H++NO3-===Cu2++NO2↑+H2O
C.钠与水反应:Na+H2O=Na++OH-+H2↑
D.向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O===Al(OH)3↓+HCO3-
15.圣路易斯大学研制的新型乙醇燃料电池, 用能传递质子(H+)的介质作溶剂, 反应为C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是
A.a极为电池的正极
B.电池正极的电极反应为:4H+ + O2 + 4e-=== 2H2O
C.电池工作时电流由a极沿导线经灯泡再到b极
D.电池工作时,1mol乙醇被氧化时就有6 mol电子转移
16.把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g) +B(g)x C(g) + 2D(g) ,经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中错误的是
A.达到平衡状态时A的转化率为50% B.x=4
C.达到平衡状态时容器内气体的压强与起始时压强比为6:5
D.5s内B的反应速率v(B)=0.05 mol/(L·s)
二、填空题(本大题有4小题,共52分)
17.(12分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
族
周期
IA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
二
①
②
③
④
三
⑤
⑥
⑦
⑧
⑨
⑩
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________(写出一种)。
18.(10分)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是 。
(2)B中溶液发生反应的离子方程式是 。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是
。
(4)过程 Ⅲ 实验的目的是 。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下
,得电子能力逐渐减弱。
19、(8分)(1)下列五种物质中①Ne ②H2O ③NH3 ④KOH ⑤Na2O,只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱的熔化 ③MgCl2溶于水 ④HCl溶于水 ⑤Na2O2溶于水,未发生化学键被破坏的是 ,仅发生离子键被破坏的是 ,仅发生共价键被破坏的是 ,既发生离子键被破坏,又发生共价键破坏的是 。(填写序号)
20、(10分)在下列转化关系中,烃A为石油的裂解气里含量较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环状化合物。请回答下列问题:
(1)写出A的结构简式 。
(2)①的反应类型为 。
(3)D物质中含氧原子团的名称为 ;写出HOCH2CH2OH与金属Na反应的化学方程式 。
(4)写出反应②的化学方程式 。
21、(12分)从海水中提取溴的工业流程如图:
(1) 以上步骤I中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。
(2) 步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 。(填写序号)
A、氧化性 B、还原性 C、挥发性 D、腐蚀性
(3)以上流程Ⅱ中涉及的离子方程式如下,请在下面方框内填上适当的化学计量数及相应物质:
Br2+CO32-===BrO3-+Br-+
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏,写出溴与二氧化硫水溶液反应的化学方程式: 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 。(填序号)
A、乙醇 B、四氯化碳 C、烧碱溶液 D、苯
化学答案
一、 单项选择题(每小题3分,共48分。)
1、D 2、B 3、B 4、D 5、C 6、D 7、A 8、A 9、D 10、D 11、C 12、C 13、A 14、D 15、B 16、A
二、填空题(本大题有4小题,共52分)
17.(12分)(1)F(1分) C(1分)
(2)F(1分) NaOH(2分) Al(OH)3(2分)
(3)Na>Mg>Al (3分) 碱性:NaOH>Mg (OH)2>Al(OH)3 (2分)(合理即可)
18、(每空2分,共10分)(1)湿润的淀粉KI试纸变蓝
(2)Cl2+2Br-=Br2+2Cl-
(3)打开活塞b,将少量C滴入D中,关闭b,取下D振荡
(4)确认C的黄色溶液无Cl2,排除Cl2对溴置换碘的实验干扰
(5)原子半径逐渐增大
19、(每空2分,共8分)(1)②③ ⑤ ④ ①
(2)① ②③ ④ ⑤
20、(每空2分,10分)(1)CH2=CH2 (2)氧化反应 (3)羧基
(4)HOCH2CH2OH+2Na→NaOCH2CH2Ona+H2↑
(5)HOCH2CH2OH+HOOCCOOH+2H2O
21、(12分)(1)富集溴元素(2分) (2)C (2分) (3)3;3;1;5;3;CO2(4分)
(4)SO2+Br2+2H2O=2HBr+H2SO4(2分)
(5)BD(2分)